题目内容
(1)已知,在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ.
①请写出该反应的热化学方程式 .
②Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,这种方法实现了高温常压下高转化率的电化学合成氨.已知阴极的电极反应为N2+6e-+6H+=2NH3,则阳极发生的电极反应为 .
(2)I.在一定温度下某容积恒定(10L)的密闭容器中加入2mol N2和4mol H2,10min后反应达到平衡时,N2的转化率为50%,则:
①用H2浓度变化来表示的化学反应速率为 .
②若在上述平衡体系中加入0.5mol Ar,10min后NH3在混合气体中的体积分数
(填“增大”、“减小”或“不变”).
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,重新达到平衡后反应放出的能量:③ ①(填“>”、“<”或“=”).
Ⅱ.在与I相同的温度下,在一个起始容器为10L压强恒定的密闭容器中发生上述反应.
①若起始时也投入2mol N2和4mol H2,则平衡时NH3的浓度I Ⅱ(填“>”、“<”或“=”).
②若向该容器中加入a mol N2、b mol H2和c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同.a、b、c应满足的关系是 .
①请写出该反应的热化学方程式
②Marnellos和Stoukides发明了电化学制备氨气方法,该方法用SCY陶瓷将阳极和阴极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,这种方法实现了高温常压下高转化率的电化学合成氨.已知阴极的电极反应为N2+6e-+6H+=2NH3,则阳极发生的电极反应为
(2)I.在一定温度下某容积恒定(10L)的密闭容器中加入2mol N2和4mol H2,10min后反应达到平衡时,N2的转化率为50%,则:
①用H2浓度变化来表示的化学反应速率为
②若在上述平衡体系中加入0.5mol Ar,10min后NH3在混合气体中的体积分数
(填“增大”、“减小”或“不变”).
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,重新达到平衡后反应放出的能量:③
Ⅱ.在与I相同的温度下,在一个起始容器为10L压强恒定的密闭容器中发生上述反应.
①若起始时也投入2mol N2和4mol H2,则平衡时NH3的浓度I
②若向该容器中加入a mol N2、b mol H2和c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同.a、b、c应满足的关系是
考点:化学平衡的计算,热化学方程式,电解原理
专题:
分析:(1)①在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ,计算6g氢气反应放热92.4KJ,标注物质聚集状态和对应反应焓变书写热化学方程式;
②阳极发生氧化反应,氢气失去电子;
(2)I.①根据三行式,求氢气浓度的变化量;
②体积一定,向平衡体系中加入0.5mol Ar,各组分的浓度不变,平衡不移动;
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,相当于增大压强,平衡正向移动,继续放出热量;
Ⅱ.①若起始时也投入2mol N2和4mol H2,在恒下体积变小,相当在原平衡体系的基础增大压强;
②用等效平衡的知识解答,恒压的条件下用极端转化的方法,相同物质对应成比例.
②阳极发生氧化反应,氢气失去电子;
(2)I.①根据三行式,求氢气浓度的变化量;
②体积一定,向平衡体系中加入0.5mol Ar,各组分的浓度不变,平衡不移动;
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,相当于增大压强,平衡正向移动,继续放出热量;
Ⅱ.①若起始时也投入2mol N2和4mol H2,在恒下体积变小,相当在原平衡体系的基础增大压强;
②用等效平衡的知识解答,恒压的条件下用极端转化的方法,相同物质对应成比例.
解答:
解:(1)①在常温下,1g H2完全转化为NH3,放出的热量为15.4kJ,6g氢气反应放热92.4KJ,反应的热化学方程式为:N2(g)+3H2 (g)=2NH3(g)△H=-92.4KJ/mol;故答案为:N2(g)+3H2 (g)=2NH3(g)△H=-92.4KJ/mol;
②阳极发生氧化反应,氢气去电子,电极反应式为:3H2-6e-=6H+,故答案为:3H2-6e-=6H+;
(2)I.N2(g)+3H2(g)=2NH3(g)
起始量:2mol 4 mol 0
变化量:2mol×50% 3mol 2mol
平衡量:1mol 1mol 2mol
①用H2浓度变化来表示的化学反应速率为:
=0.03mol/(L.min),故答案为:0.03mol/(L.min);
②体积一定,向平衡体系中加入0.5mol Ar,各组分的浓度不变,平衡不移动,所以10min后NH3在混合气体中的体积分数不变,故答案为:不变;
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,相当于增大压强,平衡正向移动,继续放出热量,所以③>①,故答案为;>;
Ⅱ.①若起始时也投入2mol N2和4mol H2,在恒下体积变小,相当在原平衡体系的基础增大压强,向气体积减小的方向移动,所以I<Ⅱ,故答案为:<;
②用等效平衡的知识解答,恒压的条件下用极端转化的方法,相同物质对应成比例,
N2(g)+3H2(g)=2NH3(g)
状态1:2mol 4 mol 0
状态2:amol bmol cmol
极端转化:(a+
)mol (b+
c)mol 0
所以
=
,即:4a=2b+c,故答案为:4a=2b+c.
②阳极发生氧化反应,氢气去电子,电极反应式为:3H2-6e-=6H+,故答案为:3H2-6e-=6H+;
(2)I.N2(g)+3H2(g)=2NH3(g)
起始量:2mol 4 mol 0
变化量:2mol×50% 3mol 2mol
平衡量:1mol 1mol 2mol
①用H2浓度变化来表示的化学反应速率为:
| ||
| 10min |
②体积一定,向平衡体系中加入0.5mol Ar,各组分的浓度不变,平衡不移动,所以10min后NH3在混合气体中的体积分数不变,故答案为:不变;
③若在①平衡体系中继续投入1mol H2、1mol N2和2mol NH3,相当于增大压强,平衡正向移动,继续放出热量,所以③>①,故答案为;>;
Ⅱ.①若起始时也投入2mol N2和4mol H2,在恒下体积变小,相当在原平衡体系的基础增大压强,向气体积减小的方向移动,所以I<Ⅱ,故答案为:<;
②用等效平衡的知识解答,恒压的条件下用极端转化的方法,相同物质对应成比例,
N2(g)+3H2(g)=2NH3(g)
状态1:2mol 4 mol 0
状态2:amol bmol cmol
极端转化:(a+
| c |
| 2 |
| 3 |
| 2 |
所以
a+
| ||
b+
|
| 2 |
| 4 |
点评:本题考查热化学方程式的书写、电化学、化学反应速率的计算、平衡移动和等效平衡的相关知识,综合性强,但有一定的难度.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
浓硫酸具有强烈的吸水性、脱水性与强的氧化性等多重特性,在中学化学实验中经常用浓硫酸制取气体,在以下实验使用的硫酸采用较高浓度的原因不是基于上述特性的是( )
| A、实验室利用Na2SO3与硫酸制取SO2气体时,一般采用浓度较大的硫酸 |
| B、向白纸上滴几滴浓硫酸 |
| C、向浓硫酸中滴加浓盐酸制取HCl气体 |
| D、利用金属Cu与浓硫酸反应制取SO2气体 |
下列系统命名法正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、2,3-二乙基-2-戊烯 |
| C、2-甲基-3-丁炔 |
| D、对二甲苯 |
下列物质属于弱电解质的是( )
| A、氯化钠 | B、蔗糖 | C、醋酸 | D、硫酸 |
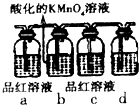 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.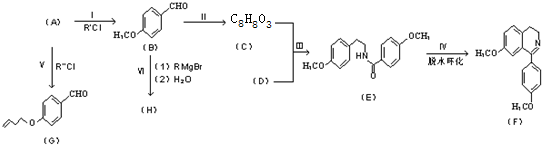
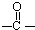 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应: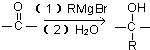
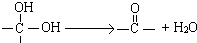
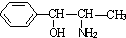 )互为同分异构体
)互为同分异构体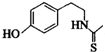 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式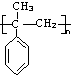 的合成路线流程图:
的合成路线流程图:

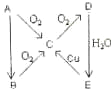 A、B、C、D、E、在一定条件下的转换条件如图所示:
A、B、C、D、E、在一定条件下的转换条件如图所示: