题目内容
10.下列金属冶炼的反应原理,错误的是( )| A. | 2NaCl(熔融)$\stackrel{通电}{→}$ 2Na+Cl2↑ | B. | MgO+H2$\stackrel{△}{→}$Mg+H2O | ||
| C. | Fe3O4+4CO3$\stackrel{高温}{→}$Fe+4CO2 | D. | 2HgO 2$\stackrel{△}{→}$Hg+O2↑ |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:A、金属钠是活泼金属,工业上采用电解熔融物的方法冶炼,故A正确;
B、金属镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,故B错误;
C、工业上采用热还原法来冶炼金属铁,故C正确;
D、对于不活泼金属Hg,可以直接用加热分解的方法将金属从氧化汞中还原出来,故D正确.
故选B.
点评 本题考查了金属冶炼的一般原理,难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.

练习册系列答案
相关题目
20.下列俗名与物质相匹配的一组是( )
| A. | 水玻璃-Na2SO4 | B. | 石膏-CaSiO3 | C. | 铁红-Fe2O3 | D. | 胆矾-FeSO4 |
1.福建漳州古雷腾龙 PX 化工厂爆炸,再次引发了人们对 PX 的关注,查阅资料知 PX 是对二甲苯(英文名称 p-xylene,缩写为 PX),它是化学工业的重要原料. 下面有关 PX 的说法不正确的是( )
| A. | PX 的结构简式为: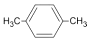 | |
| B. | PX 的同分异构体有 2 种(不包含自身) | |
| C. | PX 能发生取代反应和加成反应 | |
| D. | PX 不能使溴的四氯化碳溶液褪色 |
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,溶液中的OH-由负极向正极移动 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
15.下列指定反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 向FeI2溶液中加入少量氯水:2 Fe2++Cl2═2Fe3++2Cl-(已知:2Fe3++2I-═2 Fe2++I2) | |
| C. | 将过量铁粉投入稀硝酸中:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 将SO2通入Na2O2粉末中的主要反应为:2Na2O2+2SO2═2 Na2SO3+O2 |
2.短周期元素W、X、Y、Z原子序数依次减小,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且Y的原子半径大于Z.下列叙述正确的是( )
| A. | 原子半径:W>X>Y | |
| B. | X的单质不能与Z的氧化物反应 | |
| C. | W的单质在Y的单质中燃烧产生淡蓝色火焰 | |
| D. | X、Y可形成既有离子键又有共价键的离子化合物 |
12.下列关于药物的叙述正确的是( )
| A. | 在饭前服用鱼肝油,更有利于人体吸收药物的有效成分 | |
| B. | 可以用萃取等方法从中草药中提取有效成分 | |
| C. | 患有胃溃疡的患者可用小苏打治疗胃酸过多 | |
| D. | 服用铝膜包装的药品对人体没有任何危害 |
13.下列元素中,原子M层电子数与K层数相同的有( )
| A. | F | B. | Mg | C. | Al | D. | Si |
 .
.