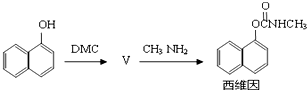
题目内容
 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.(1)中反应的离子方程式为
(2)中Fe为
(3)中被腐蚀的金属是
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)中铁和稀硫酸发生置换反应;
(2)中铁易失电子作负极、Sn作正极,负极上铁失电子发生氧化反应、正极上氢离子放电;
(3)该装置中,锌易失电子作负极、Fe作正极,作负极的金属易被腐蚀,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极.
(2)中铁易失电子作负极、Sn作正极,负极上铁失电子发生氧化反应、正极上氢离子放电;
(3)该装置中,锌易失电子作负极、Fe作正极,作负极的金属易被腐蚀,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极.
解答:
解:(1)中铁和稀硫酸发生置换反应生成亚铁离子和氢气,电极反应式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)该装置中Fe易失电子作负极、Sn作正极,负极电极反应为Fe-2e=Fe2+、正极电极反应为2H++2e=H2↑,溶液中氢离子放电导致溶液氢离子浓度降低,则溶液的pH增大,故答案为:负;Fe-2e=Fe2+;正;2H++2e=H2↑;增大;
(3)该装置中,锌易失电子作负极、Fe作正极,作原电池负极的金属易被腐蚀,所以被腐蚀的金属是Zn,电极反应为Zn-2e═Zn2+,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极,所以铁被腐蚀快慢顺序是(2)>(1)>(3),
故答案为:Zn;Zn-2e═Zn2+;(2)>(1)>(3).
(2)该装置中Fe易失电子作负极、Sn作正极,负极电极反应为Fe-2e=Fe2+、正极电极反应为2H++2e=H2↑,溶液中氢离子放电导致溶液氢离子浓度降低,则溶液的pH增大,故答案为:负;Fe-2e=Fe2+;正;2H++2e=H2↑;增大;
(3)该装置中,锌易失电子作负极、Fe作正极,作原电池负极的金属易被腐蚀,所以被腐蚀的金属是Zn,电极反应为Zn-2e═Zn2+,金属腐蚀快慢顺序是:作原电池负极>化学腐蚀>作原电池正极的电极,所以铁被腐蚀快慢顺序是(2)>(1)>(3),
故答案为:Zn;Zn-2e═Zn2+;(2)>(1)>(3).
点评:本题考查了原电池原理,根据失电子难易程度确定正负极,知道金属腐蚀快慢顺序,题目难度不大.

练习册系列答案
相关题目
下列各组中化合物的性质比较,不正确的是( )
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4>HBrO4>HIO4 |
| D、非金属性:F>O>S |
标准状况下①13.44L CH4 ②1molHCl分子 ③27.2gH2S ④2.408×1023个NH3分子.则( )
| A、体积:②>③>④>① |
| B、密度:②>③>④>① |
| C、质量:②>③>④>① |
| D、H原子个数:①>③>②>④ |
下列与试验操作相关的描述中,正确的是( )
| A、制乙酸乙酯时,迅速将乙醇注入浓硫酸中 |
| B、在石油蒸馏装置中,将温度计水银球插入液面以下 |
| C、用铂丝蘸取少量KCl溶液置于火焰上灼烧,直接观察火焰颜色,检验K+的存在 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
某一元醛发生银镜反应可得银2.16g,同质量此醛完全燃烧可生成水0.54g,则此醛是( )
| A、CH3CHO |
| B、CH2=CHCHO |
| C、CH3CH2CH2CHO |
| D、CH2=CHCH2CHO |
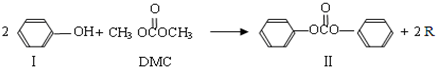
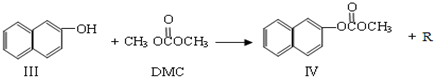
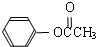 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是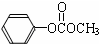 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体