题目内容
13.下列图象与所对应的叙述正确的是( )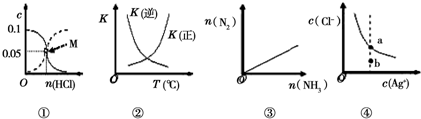
| A. | 图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化.实现表示c(NH3•H2O),虚线表示c(NH4+),处于M点时溶液呈中性 | |
| B. | 图②表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 图③表示2NH3(g)?N2(g)+3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 | |
| D. | 图④表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
分析 A.处于M点时溶液中氨水和铵根离子浓度均为0.05mol/L;
B.升高温度平衡逆移,K(正)减小;
C.增大氨气的物质的量,平衡向着正向移动,氨气和氮气的物质的量都增加;
D.蒸发部分的水后,银离子和氯离子浓度均增大.
解答 解:A.处于M点时溶液中氨水和铵根离子浓度均为0.05mol/L,一水合氨的电离程度大于铵根离子的水解程度,溶液显碱性,故A错误;
B.已知该反应正方向为放热反应,升高温度平衡逆移,K(正)减小,K(增大),图象与实际不符,故B错误;
C.反应2NH3(g)?N2(g)+3H2(g)中,增大氨气的物质的量,平衡向着正向移动,得到平衡时氮气、氨气的物质的量都增大,图象与实际相符合,故C正确;
D.蒸发部分的水后,银离子和氯离子浓度均增大,而b点到a点银离子浓度不变,故D错误;
故选C.
点评 本题考查了盐的水解和弱电解质的电离、平衡移动、难容电解质的溶解平衡等知识,题目难度中等,把握图象中的信息是解题的关键,注意掌握弱电解质的电离平衡、影响化学平衡的因素,试题培养了学生的灵活应用能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
4.设NA为阿伏加德罗常数,下列说法中不正确的是( )
| A. | 标准状况下,密度为dg/L的某气体纯净物一个分子的质量为22.4d/NAg | |
| B. | 加热条件下,20mL10mol/L的浓硝酸与足量铜反应转移电子数为0.1NA | |
| C. | 电解精炼铜的过程中转移了NA个电子,则阴极析出32g铜 | |
| D. | 1L pH=1的硫酸溶液中,含有0.1NA个H+ |
5.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| B. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| C. | 化学反应能够制造出新的物质,同时也能制造出新的元素 | |
| D. | 减少机动车尾气的排放,可以降低雾霾的发生 |
2.下列实验能获得成功的是( )
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量水解液加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
3.下列说法正确的是( )
| A. | 化合物的名称为2-甲基-5-乙基己烷 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是高分子化合物,一定条件下都能发生水解反应 | |
| C. | 在蛋白质溶液中加入硫酸铜溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |