题目内容
8.将一定质量的Mg和Al合金投入到 500mL 4mol/L一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为2mol/L 氢氧化钠溶液,欲使所得沉淀达到最大值,则需要加入该氢氧化钠溶液的体积1000mL.分析 Mg、Al与盐酸反应后,生成氯化镁、氯化铝,盐酸可能过量,滴加浓度为2mol/L 氢氧化钠溶液,欲使所得沉淀达到最大值,溶液的溶质为NaCl,结合原子守恒计算.
解答 解:沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,由钠元素守恒可知溶液中n(NaCl)=n(HCl)=n(NaOH)=0.5L×4mol/L=2mol,则NaOH溶液的体积为$\frac{2mol}{2mol/L}$=1L=1000mL,
故答案为:1000.
点评 本题考查混合物反应的计算,为高频考点,把握沉淀最大时溶液中的溶质及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.室温下,下列有关0.1mol•L-1氨水的说法正确的是( )
| A. | 溶液的pH>13 | |
| B. | 加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 该溶液中:c(OH-)=c(NH4+) | |
| D. | 完全中和等物质的量的HCl,消耗的体积与0.1 mol•L-1NaOH溶液一样多 |
16.下列实验操作正确且能达到预期目的是( )
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 验证淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
| C | 比较Mg和Al的金属活动性强弱 | 分别用镁、铝为电极,氢氧化钠为电解质的原电池装置中反应现象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
3.下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是( )
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
①CuSO4•5H2O ②S ③溴水 ④FeCl2溶液⑤KMnO4溶液 ⑥硫氰化铁溶液.
| A. | ⑥③①②④⑤ | B. | ⑤④③①②⑥ | C. | ⑥③②④①⑤ | D. | ②③①④⑤⑥ |
17.科学的假设是实验探究的先导与价值所在.下列在假设引导下的探究肯定没有意义的是( )
| A. | 探究Fe与Cl2反应可能生成FeCl2 | |
| B. | 探究Na与H2O反应可能有O2生成 | |
| C. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| D. | 探究Mg与HNO3溶液反应产生的气体中可能含有H2 |
18.下列化学用语表述正确的是( )
| A. | 钠离子的电子式:Na+ | B. | 二甲醚的分子式:CH3OCH3 | ||
| C. | CO2分子的比例模型: | D. | 16O原子的结构示意图: |
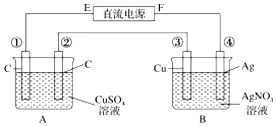 如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.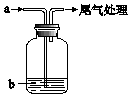 将气体a通入溶液b中,始终无明显变化的是( )
将气体a通入溶液b中,始终无明显变化的是( )