题目内容
已知H-H键的键能为436kJ/mol,Cl-Cl键的键能为243kJ/mol,H-Cl键的键能为431kJ/mol,则H2(g)+Cl2(g)═2HCl(g)的反应热(△H)等于( )
| A、862kJ/mol |
| B、183kJ/mol |
| C、-862kJ/mol |
| D、-183kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据反应热=反应物总键能-生成物总键能计算Cl2(g)+H2(g)=2HCl(g)的热效应△H.
解答:
解:H-H的键能为436kJ?mol-1、Cl-Cl键能为243kJ?mol-1、H-Cl键能为431kJ?mol-1,由于反应热=反应物总键能-生成物总键能,则:Cl2(g)+H2(g)=2HCl(g)热效应△H=436kJ?mol-1+243kJ?mol-1-2×431kJ?mol-1=-183 kJ?mol-1,
故选D.
故选D.
点评:本题考查反应热的有关计算,难度不大,注意掌握键能与反应热的关系.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
现有下列一些萘的衍生物的结构简式,与① 和②
和② 互为同分异构体的是( )
互为同分异构体的是( )
 和②
和② 互为同分异构体的是( )
互为同分异构体的是( )A、 |
B、 |
C、 |
D、 |
无色难溶于水的气体是( )
| A、SO2 |
| B、NO |
| C、Cl2 |
| D、NO2 |
有机物分子中含有40个电子,它燃烧时生成等体积的CO2和H2O,该有机物的分子式为( )
| A、C4H8 |
| B、C4H10O |
| C、C5H10 |
| D、C4H10 |
下列说法正确的是( )
| A、金属与盐溶液间的反应一定是置换反应 | ||||
| B、能与酸反应的氧化物一定是碱性氧化物 | ||||
C、
| ||||
| D、常见金属铁和铝在工业上是由热还原法制得的 |
下列说法正确的是( )
| A、在标准状况下,1摩尔任何物质的体积都约为22.4升 |
| B、22.4升氧气所含的氧原子数为2 NA个 |
| C、在标准状况下,1摩尔水的体积约为22.4升 |
| D、1摩尔某气体的体积约为22.4升时,该气体不一定处于标准状况下 |


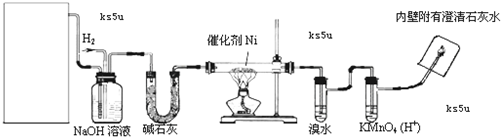
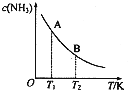 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: