题目内容
3.25℃时,0.1mol/LMOH溶液的pH约为11,该溶液与0.1mol/L的硫酸溶液混合生成1molM2SO4时放出的热量为24.6kJ,又知稀硫酸的中和热为57.3kJ/mol,则MOH电离时的△H为( )| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
分析 0.1mol/LMOH溶液的pH约为11,该溶液与0.1mol/L的硫酸溶液混合生成1molM2SO4时放出的热量为24.6kJ,即2MOH(aq)+H2SO4(aq)=M2SO4(aq)+2H2O(l),△H=-24.6kJ/mol,稀硫酸的中和热为57.3kJ/mol,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,根据盖斯定律来计算化学反应的焓变即可.
解答 解:0.1mol/LMOH溶液的pH约为11,该溶液与0.1mol/L的硫酸溶液混合生成1molM2SO4时放出的热量为24.6kJ,即①2MOH(aq)+2H+(aq)=2M+(aq)+2H2O(l),△H=-24.6kJ/mol,稀硫酸的中和热为57.3kJ/mol,②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,根据盖斯定律,$\frac{1}{2}$[①-②×2]得到:MOH(aq)?M+(aq)+OH-(aq),△H=$\frac{1}{2}$[-24.6kJ/mol-2(-57.3kJ/mol)]=45 kJ/mol.
故选A.
点评 本题考查学生盖斯定律的应用计算焓变、热化学方程式的书写知识,注意知识的迁移应用是关键,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
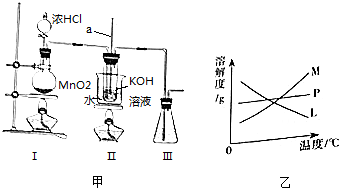
11.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
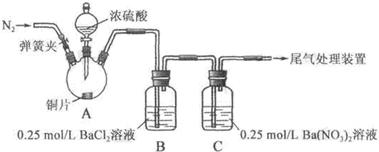
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
8.短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,X形成的常见含氧酸能氧化氢后金属,Y、Z原子最外层电子数之比为3:7,下列说法正确的是( )
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
12.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
13.下列有关碱金属元素的性质从上到下递变规律正确的是( )
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
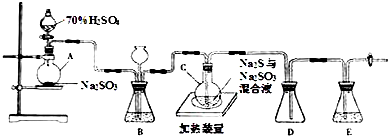
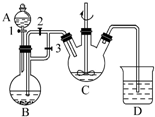 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题: