题目内容
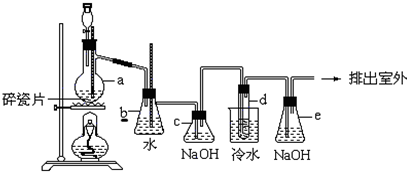
8.实验室用如图所示装置制备硫代硫酸钠晶体(Na2S2O3•5H2O).Na2S2O3•5H2O是无色透明晶体,易溶于水,Na2S2O3的稀溶液与BaCl2溶液混合无沉淀生成.
(1)先向C中烧瓶加入Na2S和Na2S2O3混合溶液,再向A中烧瓶滴加浓H2SO4.写出A中发生反应的化学方程式:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)当Na2S和Na2CO3完全消耗后,结束反应.过滤C中混合物,滤液经过蒸发(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品:洗涤晶体的操作方法是沿玻璃棒向漏斗中加蒸馏水直至浸没晶体,待水自然流完后,重复操作两到三次.
(3)为了防止污染环境,E中应加入的试剂为B(填序号).
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(4)该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂志.
①取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生(填写操作步骤和实验现象),则可确定产品中含有Na2SO3和Na2SO4.(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
②为减少产品中生成Na2SO4的量,在不改变原有装置的基础上对(1)中实验步骤进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中的空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(5)利用硫代硫酸钠跟I2反应的性质可定量测定硫代硫酸钠样品的纯度.
现取Wg硫代硫酸钠样品配制成VmL的溶液,加入指示剂,用含I2为amol/L的碘水进行滴定,耗用碘水bmL.(已知:2Na2S2O3+I2═Na2S4O6+2NaI)
①滴定过程中指示剂应选用淀粉溶液.
②样品中硫代硫酸钠(Na2S2O3•5H2O)纯度的表达式是$\frac{0.496ab}{W}$.
分析 浓硫酸和亚硫酸钠反应生成二氧化硫,用B装置收集二氧化硫,C中二氧化硫、硫化钠、碳酸钠反应生成硫代硫酸钠,D为安全瓶,防倒吸,二氧化硫有毒不能直接排空,用碱液吸收尾气.
(1)浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠;
(2)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法;
(3)二氧化硫有毒不能直接排空,用碱液吸收尾气;
(4)①根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl;硝酸、硫酸、盐酸等性质比较可知;
②亚硫酸钠易被氧化生成硫酸钠;
(5)①淀粉遇碘变蓝;
②求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=量$\frac{硫代硫酸钠质量}{样品质量}$×100%.
解答 解:(1)浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)从溶液中制取固体,应该采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥方法;洗涤晶体的操作方法是:沿玻璃棒向漏斗中加蒸馏水直至浸没晶体,待水自然流完后,重复操作两到三次,故答案为:蒸发;沿玻璃棒向漏斗中加蒸馏水直至浸没晶体,待水自然流完后,重复操作两到三次;
(3)E装置目的是吸收剩余的二氧化硫,因为二氧化硫能与氢氧化钠反应,所以E中试剂为氢氧化钠,故答案为:B;
(4)①根据:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成;Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl;BaSO4难溶于水,难溶于稀HCl,以及硝酸具有强氧化性、加入硫酸会引入硫酸根离子可知,取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可以确定产品中含有Na2SO3和Na2SO4,故答案为:向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生;
②因为亚硫酸钠易被氧化生成硫酸钠,所以为减少装置C中生成Na2SO4的量,改进后的操作是先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液,防止Na2SO3被空气中的氧气氧化,
故答案为:先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽后,再向C中烧瓶加入硫化钠和碳酸钠的混合溶液;
(5)①滴定完成后,碘会有剩余,可利用淀粉溶液来检验碘单质,淀粉遇到碘单质变蓝色,故答案为:淀粉;
②根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=amol/L×b×10-3L,知消耗的Na2S2O3的物质的量=2n(I2)=2amol/L×b×10-3L,被滴定的硫代硫酸钠质量为2amol/L×b×10-3L×158g/mol,故样品中硫代硫酸钠纯度的表达式为$\frac{2amol/L×b×1{0}^{-3}L×248g/mol}{wg}$=$\frac{0.496ab}{W}$,故答案为:$\frac{0.496ab}{W}$.
点评 本题以制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了化学方程式书写、配平以及物质的分离提纯、检验、纯度测定等,综合性较强,题目难度中等.

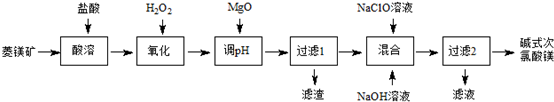
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Si$→_{△}^{O_{2}}$SiO2$\stackrel{H_{2}O}{→}$H2SiO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH2)$\stackrel{△}{→}$MgO |
| A. | 碘的升华、溴水中萃取溴、石油的分馏、煤的干馏均是物理变化 | |
| B. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 明矾是常用的净水剂,可以杀菌、消毒 |
| A. | 0.9 g H2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
| A. | NaOH+HCl=NaCl+H2O | B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
| A. | 二氧化硅是酸性氧化物,它可以跟碱反应,不能和任何酸反应 | |
| B. | 水玻璃中通入过量的二氧化碳的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 石英可以用来生产玻璃 | |
| D. | 晶体硅常被用来制造光导纤维 |