题目内容
16.自来水中因含有少量Cl-而不能用于溶液的配制,实验室为了除去自来水中的Cl-获得纯净水,可采用的方法是( )| A. | 过滤法 | B. | 结晶法 | C. | 蒸馏法 | D. | 沉淀法 |
分析 水易挥发和冷却,可先蒸发,将水与盐类分离,在冷却可得到水,以此解答该题.
解答 解:A.可溶性盐类物质不能通过过滤的方法分离,故A错误;
B.结晶法得到盐类物质,不能得到水,故B错误;
C.水一挥发,可用蒸馏的方法分离水和可溶性盐,故C正确;
D.用沉淀法,易引入其它杂质离子,故D错误.
故选C.
点评 本题考查物质的分离提纯,为高频考点,侧重物质除杂及混合物分离方法的考查,把握物质的性质及分离原理为解答的关键,题目难度不大,有利于培养学生良好的科学素养.

练习册系列答案
相关题目
1.如图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )


| A. | Z、N两种元素形成的化合物熔融状态下可以导电 | |
| B. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| C. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中 | |
| D. | 由X与M两种元素组成的化合物能与水反应 |
2.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如下图所示,下列说法正确的是( )
),其原理如下图所示,下列说法正确的是( )

 ),其原理如下图所示,下列说法正确的是( )
),其原理如下图所示,下列说法正确的是( )
| A. | A极的电极反应式为  +e-=Cl-+ +e-=Cl-+ | |
| B. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
4.一定量的木炭在盛有氮气和氧气混合气体的密闭容器中燃烧后生成CO和CO2,且测得反应后所得CO、CO2、N2的混合气体中碳元素的质量分数为24%,则反应后混合气中氮气的质量分数可能为( )
| A. | 10% | B. | 30% | C. | 50% | D. | 70% |
11.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )

| A. | 碳棒上有气体放出,溶液pH变小 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从a极到b极 | |
| D. | a极上发生了氧化反应 |
1.由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
①甲在实验之前预计△H1=△H2.他的根据是A、B中酸与碱的元数、物质的量浓度、溶液体积都相同;乙在实验之前预计△H1≠△H2,他的根据是NaOH是强碱,NH3•H2O是弱碱电离吸热.
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | △H1 | |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | △H2 |
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.9kJ/mol.(已知溶液密度均为1g/cm3)
5.在25℃时,体积一定的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是
( )
( )
| 物质 | X | Y | Z |
| 初始浓度(mol•L-1) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| B. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 反应起始时和达平衡时的压强比为3:2 |
6.下列关于碱金属的说法中不正确的是( )
| A. | 铯与水反应比钠更加剧烈 | |
| B. | 原子最外层都只有一个电子 | |
| C. | 锂燃烧生成Li2O | |
| D. | 钾可以将氯化钠溶液中的钠置换出来 |
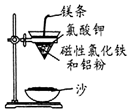 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.