题目内容
1.将ag乙醇(分子式为C2H6O)充分燃烧,将燃烧生成的气体(150℃)通过盛有过量Na2O2的干燥管(反应气体无损失),充分反应后干燥管增重bg,则a和b的关系为( )| A. | a>b | B. | a=b | C. | a<b | D. | 无法比较 |
分析 C2H6O可表示为C•CO•3H2,CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;
H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量,以此解答.
解答 解:C2H6O可表示为C•CO•3H2,CO在氧气中完全燃烧生成CO2,生成的CO2再与Na2O2反应,有关反应为:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重为CO的质量;H2在氧气中完全燃烧H2O,H2O再与Na2O2反应,有关反应为:2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重为氢气质量;
综上所述,增重的质量为CO•CO•3H2,所以b>a,
故选C.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意利用差量法从总反应方程式分析固体质量变化,是解答该题的关键.

练习册系列答案
相关题目
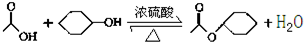
11.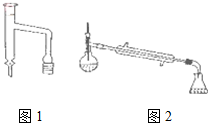 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
实验步骤:
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
12.下列说法正确的是( )
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
16.下列物质按纯净物、混合物、电解质、非电解质顺序组合正确的一组为( )
| A. | 浓硫酸、空气、小苏打、乙醇 | B. | 生石灰、漂白粉、铁、二氧化硫 | ||
| C. | 明矾、盐酸、碳酸钙、氯气 | D. | 冰水混合物、氨水、纯碱、干冰 |
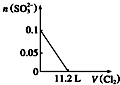
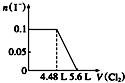
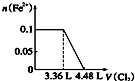
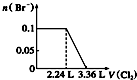
13.某含Na+的溶液中还可能含有NH4+、Fe3+、Mg2+、Br-、CO32-、SO32-.取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加BaCl2溶液无现象.为确定该溶液的组成,还需进行的实验有( )
| A. | 取样,加氯水和CCl4,振荡、静置 | |
| B. | 取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,加足量盐酸加热,用湿润的品红试纸检验气体 | |
| D. | 取样,滴加硫氰化钾溶液 |
10.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是( )
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、K+、H+、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
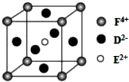 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示): .
.