题目内容
12.在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合气体的平均相对分子质量是40,混合物中CO和CO2物质的量之比是1:3,CO的体积分数是25%,C和O原子个数比是4:7,密度是1.79(保留两位小数) g/L.分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的总的物质的量,根据$\overline{M}$=$\frac{m总}{n总}$计算平均摩尔质量,进而确定平均相对分子质量,设CO的物质的量为x,CO2的物质的量为y,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算CO的体积分数,CO质量分数=$\frac{m(CO)}{m(混合气体)}$×100%,根据m=nM计算CO的质量,根据分子式计算C、O原子物质的量,进而计算C、O原子数目之比,根据ρ=$\frac{m}{V}$计算混合气体的密度.
解答 解:标准状况下,混合气体的物质的量为:n=$\frac{V}{{V}_{m}}$=$\frac{6.72L}{22.4L/mol}$=0.3mol,混合气体的平均摩尔质量$\overline{M}$=$\frac{m}{n}$=$\frac{12g}{0.3mol}$=40g/mol,故平均相对分子质量是40;
设CO的物质的量为x,CO2的物质的量为y,则:$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=12}\end{array}\right.$解得:x=0.075mol,y=0.225mol,
此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3;
CO的体积分数是=$\frac{0.075mol}{0.3mol}$×100%=25%;
CO的质量=0.075mol×28g/mol=2.1g,故CO的质量分数=$\frac{2.1g}{12g}$×100%=17.5%;
C和O原子个数比=(0.075mol+0.225mol):(0.075mol+0.225mol×2)=4:7;
混合气体的密度ρ=$\frac{m}{V}$=$\frac{12g}{6.72L}$=1.79 g/L,
故答案为:40;1:3;25%;4:7;1.79.
点评 本题考查混合物计算、物质的量有关计算,难度不大,注意对公式的理解与灵活应用.

 如图:A处通入氯气.关闭B阀时,C处干燥的红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断不正确的是( )
如图:A处通入氯气.关闭B阀时,C处干燥的红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断不正确的是( )| A. | D中盛放的可能是浓硫酸 | B. | D中盛放的可能是氢氧化钠溶液 | ||
| C. | D中盛放的可能是饱和食盐水 | D. | 通入的氯气是未经干燥的氯气 |
| A. | 元素原子的电子层数呈周期性变化 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
③P:
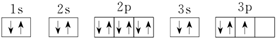
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦C:
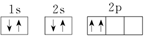
| A. | ①③⑥ | B. | ②④⑦ | C. | ③④⑥ | D. | ③④⑦ |
| A. | 石油的催化重整是获得芳香烃的主要途径 | |
| B. | 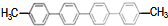 苯环上的一氯代物有4种 苯环上的一氯代物有4种 | |
| C. | 燃烧等质量的甲烷和丙烯,丙烯需要的O2更多 | |
| D. | 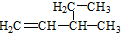 命名为3-甲基-1-戊烯 命名为3-甲基-1-戊烯 |
①加入足量氯水 ②取少量试液 ③加入少量KSCN溶液.
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
| A. | 水变成水蒸气 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |



 .
. 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答: