题目内容
19.下列关于元素周期律的叙述正确的是( )| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |
分析 A.在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2;
B.同周期从左到右原子半径逐渐减小;
C.元素的最低负价是-4价,最高正价是+7价;
D.元素性质是由原子结构的周期性变化引起的.
解答 解:A.从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2,故A错误;
B.同周期元素原子的电子层数相同,随着元素原子序数的递增,同周期从左到右原子半径逐渐减小,故B错误;
C.元素的最低负价是-4价,最高正价是+7价,随着元素原子序数的递增,一般情况下元素的最高正价从+1到+7,负价从-4到-1重复出现,故C错误;
D.元素性质是由原子结构的周期性变化引起的,即元素原子核外电子排布的周期性变化引起的,则原子半径、元素主要化合价和元素性质周期性变化的主要原因是元素原子核外电子排布的周期性变化,故D正确.
故选D.
点评 本题考查元素周期表和元素周期律知识,侧重于基础知识的考查,能很好地培养学生的良好的科学素养,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
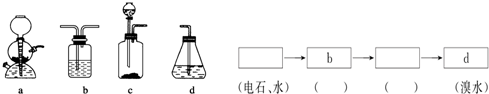
9. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
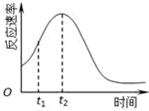
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
4.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
11.除去下列物质中的少量杂质(括号内的物质为杂质),所选用的试剂或方法不正确的是( )
| A. | CO2(SO2):饱和NaHCO3溶液 | B. | NO(NO2):水 | ||
| C. | Cl2(HCl):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
8.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )


| A. | 原子半径:Br>Se>P | B. | 还原性:S 2 ->Se 2 ->Br - | ||
| C. | SeO 2既有氧化性又有还原性 | D. | 在Se2Br2分子中只含有极性键 |
9.下列物质不能与金属钠反应的是( )
| A. | 水 | B. | 煤油 | C. | 盐酸 | D. | 乙醇 |
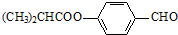 .合成M的一种途径如下:
.合成M的一种途径如下:
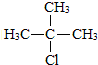 ,D中官能团的名称是羧基.
,D中官能团的名称是羧基.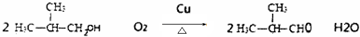 .
. .
.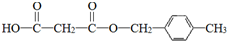 .
.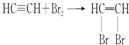
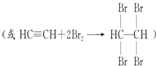 .
.