题目内容
19.已知葡萄糖的结构简式CH2OH-(CHOH)4-CHO①对葡萄糖的叙述正确的是ABCE
A易溶于水 B是还原糖 C属于多羟基醛D常温是液态 E加热可以与新制氢氧化铜反应
②1mol葡萄糖与过量乙酸发生酯化反应最多消耗乙酸5mol
③葡萄糖与银氨溶液反应的化学方程式2Ag(NH3)2OH+CH2OH(CHOH)4CHO$\stackrel{水浴加热}{→}$2Ag↓+CH2OH(CHOH)4COONH4+3NH3+H2O.
分析 ①葡萄糖是多羟基醛,水溶性好,能被弱氧化剂氧化,具有还原性,常温下呈固态;
②酯化反应是羟基去氢,羧基去羟基结合成水,其余部分互相结合成酯,1mol葡萄糖中有5mol-OH,可以消耗5mol-COOH;
③葡萄糖中的醛基能被弱氧化剂氧化,可发生银镜反应.
解答 解:①葡萄糖是多羟基醛,水溶性好,能被弱氧化剂氧化,如银氨溶液、新制氢氧化铜悬浊液,具有还原性,常温下呈固态,
故答案为:ABCE;
②酯化反应是羟基去氢,羧基去羟基结合成水,其余部分互相结合成酯,1mol葡萄糖中有5mol-OH,可以消耗5mol-COOH,乙酸是一元酸,则最多消耗5mol乙酸,
故答案为:5;
③葡萄糖中的醛基可被银氨溶液氧化,方程式为:2Ag(NH3)2OH+CH2OH(CHOH)4CHO$\stackrel{水浴加热}{→}$2Ag↓+CH2OH(CHOH)4COONH4+3NH3+H2O,
故答案为:2Ag(NH3)2OH+CH2OH(CHOH)4CHO$\stackrel{水浴加热}{→}$2Ag↓+CH2OH(CHOH)4COONH4+3NH3+H2O.
点评 本题考查了葡萄糖的性质,注意官能团决定有机物的主要化学性质,题目难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
9.下列反应的离子方程式书写正确的是( )
| A. | Ca(HCO3)2与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| C. | 实验室保存的氯化亚铁溶液在空气中被氧化:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 饱和Na2CO3溶液吸收少量HCl尾气:CO32-+2H+═H2O+CO2↑ |
4.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 熔沸点高低:金刚石>NaCl>H2O>H2 | |
| D. | 还原性强弱:F->Cl->Br->I- |
11.下列关于化学反应的认识,错误的是( )
| A. | 会引起化学键的变化 | B. | 必然引起物质状态的变化 | ||
| C. | 会产生新物质 | D. | 必然伴随着能量的变化 |
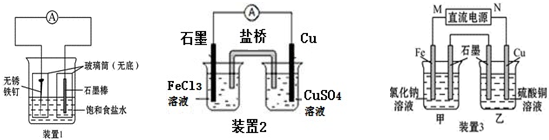
16. 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
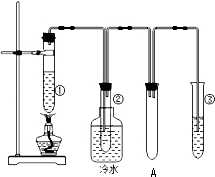 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水. B.
B.
 D.
D.
 氨和硝酸都是重要的化学品.
氨和硝酸都是重要的化学品.