题目内容
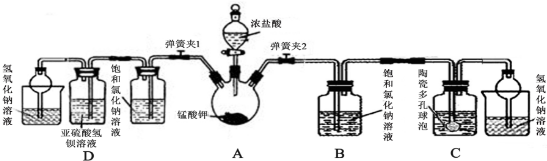
9.下列反应的离子方程式书写正确的是( )| A. | Ca(HCO3)2与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| C. | 实验室保存的氯化亚铁溶液在空气中被氧化:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 饱和Na2CO3溶液吸收少量HCl尾气:CO32-+2H+═H2O+CO2↑ |
分析 A.反应生成碳酸钙、碳酸钠、水;
B.发生沉淀的转化;
C.发生氧化还原反应,生成氯化铁、水;
D.反应生成碳酸氢钠、NaCl.
解答 解:A.Ca(HCO3)2与过量NaOH溶液反应的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故A错误;
B.向AgCl悬浊液中加入KI溶液的离子反应为AgCl(s)+I-(aq)═AgI(s)+Cl-(aq),故B正确;
C.实验室保存的氯化亚铁溶液在空气中被氧化的离子反应为4Fe2++O2+4H+═4Fe3++2H2O,故C正确;
D.饱和Na2CO3溶液吸收少量HCl尾气的离子反应为CO32-+H+═HCO3-,故D错误;
故选BC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
19.下列各组气体,在通常条件下能稳定共存的是( )
| A. | NH3、O2、HCl | B. | N2、H2、HCl | C. | CO2、NO、O2 | D. | H2S、O2、SO2 |
4.2011年1月14日,我国材料科学的一代宗师师昌绪,荣获2010年度中国科技界的最高荣誉“国家最高科学技术奖”,他主要从事高温合金及高合金钢研究,领导研制出我国第一代空心气冷铸造镍基高温合金涡轮叶片等多项成果,下列关于合金的叙述正确的是( )
| A. | 合金的熔点一般比组分金属高 | B. | 合金中只含金属元素 | ||
| C. | 合金的机械性能一般比组分金属好 | D. | 合金的硬度一般比组分小 |
14.能说明元素X的气态原子得电子能力比元素Y的气态原子得电子能力强的事实是( )
| A. | 元素周期表中X位于Y的上一周期 | |
| B. | X的含氧酸的酸性强于Y的含氧酸的酸性 | |
| C. | 将H2X、HY分别加热至500℃,只有HY发生分解 | |
| D. | Xn-的还原性强于Ym- |
1.金属铝可以溶于氢氧化钠溶液,有关该反应,下列说法正确的是( )
| A. | 同时生成的气体是氧气 | |
| B. | 氧化剂是氢氧化钠和水 | |
| C. | 当产生1.5mol气体时电子转移3NA个 | |
| D. | 这个反应体现了金属的通性 |
18.一定温度压强的理想气体,影响其所占体积大小的主要因素有( )
a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
a.分子直径的大小 b.分子间距离的大小
c.分子间的引力大小 d.分子数目的大小.
| A. | a、b | B. | b、c | C. | a、d | D. | b、d |
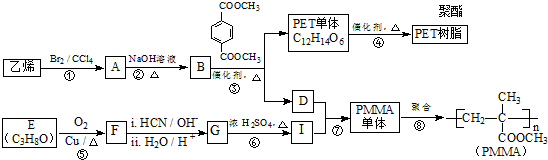
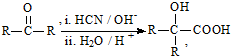 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.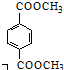 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH .
.