题目内容
常温常压下,24mL H2和O2的混合气体,点燃反应后再恢复到原来温度和压强,剩余气体体积为3mL,则原混合气体中H2和O2的分子个数比可能是( )
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
考点:有关混合物反应的计算
专题:计算题
分析:燃烧发生反应:2H2+O2
2H2O,剩余气体可能为H2,也可能为O2,据此讨论计算H2和O2的体积,相同条件下,气体分子数目之比等于其体积之比.
| ||
解答:
解:若剩余气体为H2,则:
2 H2+O2
2H2O△V
2 1 3
14mL 7mL 24mL-3mL=21mL
故混合气体中氢气为24mL-7mL=17mL
则原混合气体中H2和O2的分子个数比为17mL:7mL=17:7;
若剩余气体为O2,则:
2 H2+O2
2H2O△V
2 1 3
14mL 7mL 24mL-3mL=21mL
故混合气体中氧气为24mL-14mL=10mL
则原混合气体中H2和O2的分子个数比为14mL:10mL=7:5;
故选D.
2 H2+O2
| ||
2 1 3
14mL 7mL 24mL-3mL=21mL
故混合气体中氢气为24mL-7mL=17mL
则原混合气体中H2和O2的分子个数比为17mL:7mL=17:7;
若剩余气体为O2,则:
2 H2+O2
| ||
2 1 3
14mL 7mL 24mL-3mL=21mL
故混合气体中氧气为24mL-14mL=10mL
则原混合气体中H2和O2的分子个数比为14mL:10mL=7:5;
故选D.
点评:本题考查混合物计算,难度不大,关键是讨论确定剩余的气体,再结合方程式计算.

练习册系列答案
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
| A、2Na218O2+2H2O=4Na18OH+O2↑ |
| B、2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O |
| C、NH3?2H2O+HCl=NH4Cl+2H2O |
| D、K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O |
将Na2CO3?10H2O和NaHCO3、Na2CO3组成的混合物10.68g,溶于水制成100ml溶液,其中Na+的浓度为1.4mol/L,若将等质量的该混合物加热到恒重,则所得固体的质量为( )
| A、7.42g | B、5.3g |
| C、6.36g | D、8.48g |
下列实验装置用途正确的是( )
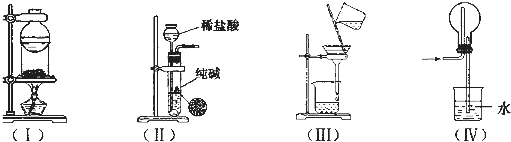

| A、装置(I)用于I2与NH4Cl混合物的分离 |
| B、装置(Ⅱ)用于制取少量纯净的CO2气体 |
| C、装置(Ⅲ)用于去除Fe(0H)3胶体中含有的可溶性物质 |
| D、装置(Ⅳ)用于HC1的吸收,以防倒吸 |
