题目内容
将Na2CO3?10H2O和NaHCO3、Na2CO3组成的混合物10.68g,溶于水制成100ml溶液,其中Na+的浓度为1.4mol/L,若将等质量的该混合物加热到恒重,则所得固体的质量为( )
| A、7.42g | B、5.3g |
| C、6.36g | D、8.48g |
考点:有关混合物反应的计算
专题:计算题
分析:固体混合物加热至恒重时,剩余固体为Na2CO3,根据Na元素守恒计算出剩余固体Na2CO3的物质的量,进而计算Na2CO3质量.
解答:
解:100mL溶液中c(Na+)═1mol?L-1,则n(Na+)═0.1L×1.4mol?L-1=0.14mol,
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=
=0.07mol,m(Na2CO3)=0.07mol×106g/mol=7.42g,
故选:A.
固体混合物加热至恒重时,剩余固体为Na2CO3,由钠元素守恒,则n(Na2CO3)=
| 0.14mol |
| 2 |
故选:A.
点评:本题考查混合物的计算,难度不大,注意加热后剩余固体的成分为碳酸钠,根据钠元素质量守恒计算.

练习册系列答案
相关题目
下列叙述不正确的是( )
| A、在基态多电子的原子中,最易失去的电子能量最高电离能也最小 |
| B、锗的第一电离能高于碳而电负性低于碳 |
| C、PH3分子呈三角锥形,沸点比NH3低 |
| D、SiF4和SO32-的中心原子均为sp3杂化 |
常温常压下,24mL H2和O2的混合气体,点燃反应后再恢复到原来温度和压强,剩余气体体积为3mL,则原混合气体中H2和O2的分子个数比可能是( )
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρg?cm-1,质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A、溶质的质量分数为ω=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液中c (OH-)=
| ||
| D、上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的是( )
A、 制取氯气 |
B、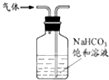 除去氯气中的少量氯化氢 |
C、 分离二氧化锰和氯化锰溶液 |
D、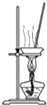 蒸干氯化锰溶液制MnCl2?4H2O |
在温度不变的条件下,密闭容器中发生如下反应:2SO2+O2?2SO3,下列叙述能够说明反应已经达到平衡状态的是( )
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |
