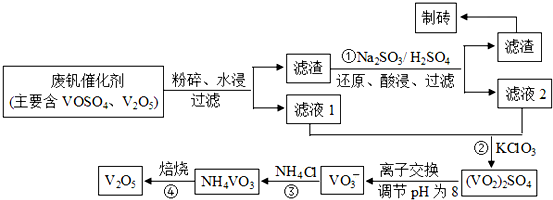
题目内容
N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:则该元素是 (填写元素符号).
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:同一种元素的原子,其电离能随着失电子个数的增多而增大,当原子失去电子变为稳定状态时,如果继续失电子,则其电离能会出现突兀性变化,据此判断该主族元素最外层电子数.
解答:
解:根据元素电离能知,第三电离能和第四电离能相差较大,说明该元素原子失去3个电子时变为稳定结构,则该主族元素原子最外层有3个电子,N、Al、Si和Zn四种元素的原子中只有Al原子最外层有3个电子,则该元素是Al,故答案为:Al.
点评:本题考查元素电离能的应用,明确同一元素电离能变化与主族元素最外层电子数的关系是解本题关键,熟练掌握前36号元素原子结构,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g.若硝酸的还原产物只有NO,下列说法正确的是( )
| A、上述测定不能达到实验目的 |
| B、剩余的7.48g金属为铜 |
| C、共生成NO气体0.04mol |
| D、该合金中铜的质量分数为69.2% |
北京2008奥运会金牌直径为70mm,厚6mm.某化学兴趣小组对金牌的成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金).为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
| A、硫酸铜溶液 | B、浓盐酸 |
| C、稀硝酸 | D、硝酸银溶液 |
下列说法不正确的是( )
| A、汽车尾气中有NOx,主要是汽油不充分燃烧引起的 |
| B、日用铝制品表面覆盖着氧化膜,对金属起保护作用 |
| C、大气中CO2含量的增加会导致温室效应加剧 |
| D、NO2或SO2都会导致酸雨的形成 |
常温常压下,24mL H2和O2的混合气体,点燃反应后再恢复到原来温度和压强,剩余气体体积为3mL,则原混合气体中H2和O2的分子个数比可能是( )
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
下列实验方案正确且能达到相应实验预期目的是( )
A、 制取少量蒸馏水 |
B、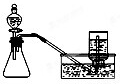 用铜和浓硝酸混合制取少量NO2 |
C、 比较MnO2、Cl2、I2的氧化性 |
D、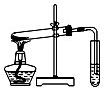 探究NaHCO3的热稳定性 |