题目内容
20.下列排序错误的是( )| A. | 原子半径:Na>Mg>C>N | B. | 热稳定性:HI<HBr<HCl<HF | ||
| C. | 最高正化合价:Si<P<S<Cl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3>KOH |
分析 A.原子核外电子层数越多,半径越大,同周期元素从左到右原子半径逐渐减小;
B.非金属性越强,气态氢化物越稳定;
C.第三周期元素,从左到右原子核外最外层电子数逐渐增多,最高正化合价逐渐增大;
D.金属性越强,则对应的最高价氧化物的水化物的碱性越强.
解答 解:A.Na、Mg,C、N分别位于相同周期,同周期元素从左到右原子半径逐渐减小,则Na>Mg;C>N,又原子核外电子层数越多,半径越大,则Na>Mg>C>N,故A正确;
B.非金属性F>Cl>Br>I,非金属性越强,气态氢化物越稳定,故B正确;
C.第三周期元素,从左到右原子核外最外层电子数逐渐增多,最高正化合价逐渐增大,故C正确;
D.金属性K>Na>Mg>Al,金属性越强,则对应的最高价氧化物的水化物的碱性越强,故D错误.
故选D.
点评 本题考查非金属性、金属性的比较及元素周期律,熟悉元素的性质变化规律及非金属性、金属性的比较方法即可解答,难度不大.

练习册系列答案
相关题目
8.下列说法中不正确的是( )
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属之间形成的化学键不一定是共价键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 在共价化合物中也可能含有离子键 |
5.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断不正确的是( )
| A. | 电子层数:X>Y>Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 原子序数:X<Y<Z | D. | 元素的非金属性强弱:X<Y<Z |
12.下列物质中含有极性共价键的是( )
| A. | 氢气 | B. | 氮气 | C. | 氧气 | D. | 氨气 |
9.下列有关有机化合物的认识正确的是( )
| A. | 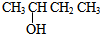 的名称为2-羟基丁烷 的名称为2-羟基丁烷 | |
| B. | 乙酸、乙酸乙酯和淀粉的最简式均为CH2O | |
| C. | (CH3)3CCH2C(CH3)=CH2的名称为 2,2,4-三甲基-1-戊烯 | |
| D. | 按系统命名法CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
18.已知:可逆反应N2(g)+3H2(g)?2NH3(g)△H<0.现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ.在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2.下列叙述中正确的是( )
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |


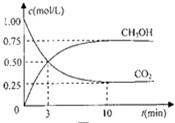 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,