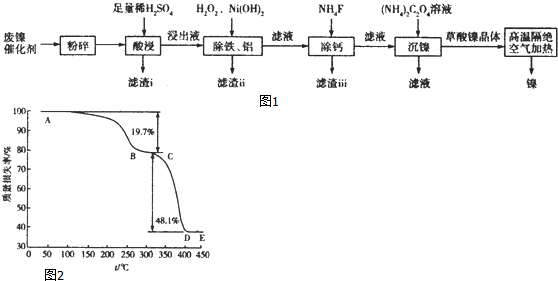
题目内容
5.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断不正确的是( )| A. | 电子层数:X>Y>Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 原子序数:X<Y<Z | D. | 元素的非金属性强弱:X<Y<Z |
分析 同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,非金属性X<Y<Z,根据同主族非金属性的递变规律比较.
解答 解:同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,非金属性X<Y<Z.
A.原子序数的关系为X>Y>Z,同主族元素从上到下电子层数增大,故A正确;
B.元素非金属性越强,则对应氢化物的稳定性越强,则气态氢化物的稳定性:XH3<YH3<ZH3,故B正确;
C.原子序数的关系为X>Y>Z,故C错误;
D.最高价含氧酸的酸性:H3XO4<H3YO4<H3ZO4,则非金属性:X<Y<Z,故D正确,
故选C.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,注意理解同主族元素性质的相似性和递变性,同主族从上到下,原子的半径逐渐增大,非金属性减弱,氢化物的稳定性减弱,最高价氧化物对应的水化物的酸性减弱.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列排序错误的是( )
| A. | 原子半径:Na>Mg>C>N | B. | 热稳定性:HI<HBr<HCl<HF | ||
| C. | 最高正化合价:Si<P<S<Cl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3>KOH |
14.乙醇可以发生下列反应,在反应里乙醇分子断裂C-O键而失去羟基的是( )
| A. | 乙醇与乙酸发生酯化反应 | B. | 乙醇的催化氧化 | ||
| C. | 乙醇与钠反应生成氢气 | D. | 乙醇在浓硫酸存在下加热至170℃ |
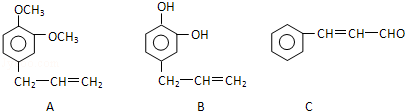
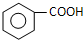 +
+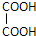 则C9H8O的结构简式为
则C9H8O的结构简式为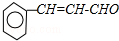 .
.
 ;
;
 .
.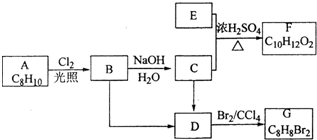 A~G都是有机化合物,它们的转化关系如图:
A~G都是有机化合物,它们的转化关系如图: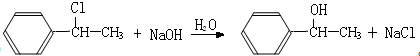 .
. (填结构简式).
(填结构简式). ;
;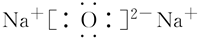 .
.