题目内容
10.下列说法中正确的是( )| A. | 化学反应放热是因为反应物的总能量低于生成物的总能量 | |
| B. | 不需要加热就能发生的反应是放热反应 | |
| C. | 化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能 | |
| D. | 氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化 |
分析 A.依据反应前后能量守恒判断,反应物能量高于生成物,反应是放热反应;
B.吸热反应有些不需要加热等引发条件也可进行;
C.化学反应过程中可以放热,化学能转化为热能,也可以利用氧化还原反应形成原电池反应,转化为电能;
D.化学变化的实质是旧化学键断裂,新化学键形成的过程.
解答 解:A.放热反应中,反应物的总能量大于生成物的总能量,故A错误;
B.不加热发生的反应可能是吸热反应,如氢氧化钡晶体和氯化铵溶液的反应是吸热反应,不需任何条件蒸发进行,故B错误;
C.化学反应过程中一定存在能量变化,主要是热量变化,化学能转化为热能,氧化还原反应可以设计为原电池反应,化学能转化为电能,故C正确;
D.化学反应是实质是有旧化学键的断裂和新化学键的形成,离子键被破坏的变化不一定发生化学变化,氯化钠晶体熔化时,离子键被破坏,吸收能量,无化学键形成,未发生化学变化,故D错误;
故选C.
点评 本题考查了化学反应能量变化的实质分析,主要是能量变化形式、能量变化的判断依据,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
20.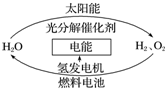 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
1.分类法是一种行之有效、简单易行的科学方法.下列关于“Na2CO3”的分类错误的是( )
| A. | 电解质 | B. | 碳酸盐 | C. | 钠盐 | D. | 碱 |
18.生活中碰到的某些问题常涉及到化学知识,下列叙述中错误的是( )
| A. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 废弃的塑料,金属、纸制品及玻璃都是可回收再利用的资源 | |
| C. | 大气污染物SO2、CO和NO2主要来源于煤的燃烧和汽车排放的尾气 | |
| D. | 变质的油脂有难闻的特殊气味,是由于油脂发生了化学变化 |
5.丰原集团生产的车用乙醇汽油是把变性燃料乙醇和汽油按一定比例混配形成的一种新型汽车燃料.经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体的排放量.下列有关乙醇汽油的说法正确的是( )
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 和乙二醇互为同系物 |
15.下列物质中,属于纯净物的是( )
| A. | 矿泉水 | B. | 盐酸 | C. | 液氨 | D. | 漂白粉 |
2.下列物质中,能使淀粉碘化钾溶液变蓝的是( )
| A. | 食盐水 | B. | 氯水 | C. | 溴化钾 | D. | 碘化钾 |
19.下表为元素周期表的一部分,列出10种元素在周期表中的位置.用化学符号回答下列问题:
(1)③、④二种元素的原子,原子半径由大到小的顺序是Ca>Mg.
(2)⑧和⑨两元素的核电荷数之差为18
(3)元素⑦的一种氢化物常温下和元素②的单质反应的化学方程式为2K+H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO
(4)①和⑨两元素形成化合物的化学式为NaBr;该化合物灼烧的焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2.
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑩ | ⑧ | |||
| 第4周期 | ② | ④ | ⑨ |
(2)⑧和⑨两元素的核电荷数之差为18
(3)元素⑦的一种氢化物常温下和元素②的单质反应的化学方程式为2K+H2O=2KOH+H2↑;若该氢化物和元素⑧的单质反应,则化学方程式为Cl2+H2O=HCl+HClO
(4)①和⑨两元素形成化合物的化学式为NaBr;该化合物灼烧的焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为Cl2+2NaBr=2NaCl+Br2.
10.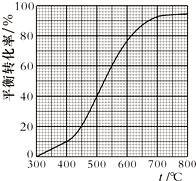 工业上以乙苯催化脱氢制取苯乙烯的反应如下:
工业上以乙苯催化脱氢制取苯乙烯的反应如下:
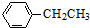 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$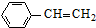 (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定.在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示.
已知:气体分压(p分)=气体总压(p总)×体积分数.
不考虑副反应,下列说法正确的是( )
 工业上以乙苯催化脱氢制取苯乙烯的反应如下:
工业上以乙苯催化脱氢制取苯乙烯的反应如下: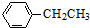 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$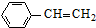 (g)+H2(g)
(g)+H2(g)现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定.在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示.
已知:气体分压(p分)=气体总压(p总)×体积分数.
不考虑副反应,下列说法正确的是( )
| A. | 400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低 | |
| B. | 500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动 | |
| C. | 550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{9}{16}$×p总 | |
| D. | 550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍 |