题目内容
12.下面列出了几组物质,请将物质的合适序号填写在横线上.①O2和O3
②CH3CH3和CH3CH2CH2CH3
③${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl
④CH3CH(CH3)CH2CH3和C(CH3)4
⑤
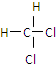 和
和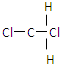
(1)属于同位素的是:③
(2)属于同素异形体的是:①
(3)属于同系物的是:②
(4)属于同分异构体的是:④
(5)属于同一物质:⑤.
分析 质子数相同,中子数不同的同种元素的不同原子互称同位素;
同种元素形成的不同单质互称同素异形体;
结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
具有相同分子式而结构不同的化合物互为同分异构体;
组成和结构都相同的物质为同一物质;
根据以上概念进行判断.
解答 解:(1)③${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl都属于氯元素,质子数相同,中子数不同互为同位素,故答案为:③;
(2)①O2和O3是同种元素形成的不同单质互为同素异形体,故答案为:①;
(3)②CH3CH3和CH3CH2CH2CH3都属于烷烃,它们结构相似,在分子组成上相差2个CH2原子团互为同系物,故答案为:②;
(4)④CH3CH(CH3)CH2CH3和C(CH3)4分子式相同而结构不同,互为同分异构体,故答案为:④;
(5)⑤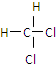 和
和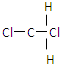 结构和组成相同,属于同一种物质,故答案为:⑤.
结构和组成相同,属于同一种物质,故答案为:⑤.
点评 本题考查同位素、同素异形体、同系物、同分异构体的定义,明确概念是解题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列有关实验装置进行的相应实验,不能达到实验目的是( )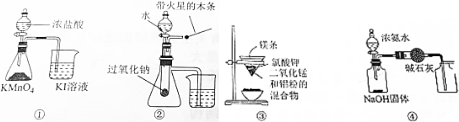

| A. | 用图①装置比较KMnO4、Cl2、I2的氧化性强弱 | |
| B. | 用图②装置验证过氧化钠与水反应既生成氧气又放热 | |
| C. | 用图③装置可制得金属锰 | |
| D. | 用图④装置制取并收集干燥纯净的NH3 |
3.单晶硅是信息产业中重要的基础材料.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,AlCl3,FeCl3遇水均易水解,有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,装置D的硬质玻璃管中发生的主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(2)装置C中的试剂是浓硫酸;D、E间导管短且粗的原因是防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管.
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH、0.01mol/L KMnO4溶液、溴水、淀粉-KI、品红等溶液.
取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验:请完成下表:

实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,AlCl3,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,装置D的硬质玻璃管中发生的主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(2)装置C中的试剂是浓硫酸;D、E间导管短且粗的原因是防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管.
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH、0.01mol/L KMnO4溶液、溴水、淀粉-KI、品红等溶液.
取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验:请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
7.针对实验室制取氨气,下列说法不正确的是( )
| A. | 发生装置与氯酸钾制取氧气相同 | |
| B. | 可以用碱石灰干燥氨气 | |
| C. | 棉花的作用和高锰酸钾制取氧气一样 | |
| D. | 氨气验满的方法是将湿润的红色石蕊试纸放于集气瓶附近 |
4.在①浓盐酸 ②氧气 ③浓硫酸 ④氢氟酸 ⑤氢氧化钾溶液中,能与单质硅起化学反应的是( )
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②④⑤ |
1.某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了如图1实验流程图:

请回答以下问题:
(1)为验证气体A,按图2所示进行实验:若能观察到KMnO4溶液(紫红色)褪色的现象,即可证明火柴头上含有S元素.
(2)要证明火柴头中含有Cl元素的后续实验步骤是取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素.
(3)有学生提出检验火柴头上KClO3另一套实验方案:(如图3)
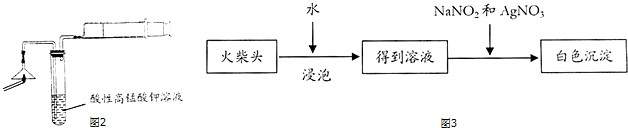
有关的离子反应方程式为ClO3-+3NO2-+Ag+=AgCl↓+3NO3-,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是二氧化锰和浓盐酸加热也发生反应生成氯气.
(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验②和③,证明物质D的用量越大,反应速率越快.
(5)写出步骤①中发生反应的两个化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.

请回答以下问题:
(1)为验证气体A,按图2所示进行实验:若能观察到KMnO4溶液(紫红色)褪色的现象,即可证明火柴头上含有S元素.
(2)要证明火柴头中含有Cl元素的后续实验步骤是取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素.
(3)有学生提出检验火柴头上KClO3另一套实验方案:(如图3)

有关的离子反应方程式为ClO3-+3NO2-+Ag+=AgCl↓+3NO3-,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上KClO3的存在,其理由是二氧化锰和浓盐酸加热也发生反应生成氯气.
(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
| 实验次数 | H2O2溶液质量分数% | H2O2溶液用量/毫升 | 物质D用量/克 | 反应温度/℃ | 收集气体体积/毫升 | 所需时间/秒 |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
(5)写出步骤①中发生反应的两个化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
2.下列实验装置图(有些图中部分夹持仪器未画出)不能达到其实验目的是( )
| A. | 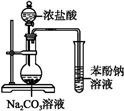 证明酸性:盐酸>碳酸>苯酚 | B. |  实验室制取乙酸乙酯 | ||
| C. |  石油分馏 | D. |  实验室制取硝基苯 |