题目内容
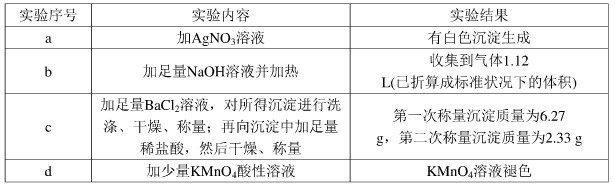
 已知:还原性HSO3->I?,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I?,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0-b:3HSO3-+IO3-═3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2mol |
| C、b-c间I2是还原产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.08mol |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:还原性HSO3->I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物.
解答:
解:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,故A正确;
B.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
×3=1.2mol,故B正确;
C.根据图象知,b-c段内,碘离子部分被氧化生成碘单质,发生反应的离子方程式为IO3-+6H++5I-═3H2O+3I2,所以I2是既是还原产物又是氧化产物,故C错误;
D.根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的KIO3的物质的量为
xmol,消耗碘离子的物质的量=
xmol,剩余的碘离子的物质的量=(1-
x)mol,当溶液中n(I-):n(I2)=5:2时,即(1-
x):x=5:2,x=0.24mol,根据原子守恒加入碘酸钾的物质的量=1mol+0.24mol×
=1.08mol,故D正确;
故选C.
A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,故A正确;
B.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
| 0.4mol |
| 1 |
C.根据图象知,b-c段内,碘离子部分被氧化生成碘单质,发生反应的离子方程式为IO3-+6H++5I-═3H2O+3I2,所以I2是既是还原产物又是氧化产物,故C错误;
D.根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为xmol,则根据反应IO3-+6H++5I-═3H2O+3I2,消耗的KIO3的物质的量为
| 1 |
| 3 |
| 5 |
| 3 |
| 5 |
| 3 |
| 5 |
| 3 |
| 1 |
| 3 |
故选C.
点评:本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,明确氧化性、还原性前后顺序是解本题关键,结合方程式进行分析解答,易错点是D,根据物质间的反应并结合原子守恒计算,题目难度中等.

练习册系列答案
相关题目
下列叙述中,错误的是( )
| A、用新制的氢氧化铜悬浊液检验葡萄糖 |
| B、用油脂生产肥皂 |
| C、酶不属于蛋白质 |
| D、在鸡蛋清溶液中滴入浓硝酸,微热会产生黄色物质 |
科学家P.Tatapudi等人首先使用在空气中电解纯水(酸性条件下)的方法制得臭氧.同时还得到了过氧化氢,下列电极反应式正确的是( )
| A、阳极反应:3O2+6H++6e-=3H2O2 |
| B、阳极反应:3H2O一6e-=O3+6H+ |
| C、阴极反应:3O2+6H2O+6e-=3H2O2+6OH- |
| D、阴极反应:3H2O一6e-=O3+6H+ |
下列离子组能大量共存且溶液为无色透明的是( )
| A、H+、K+、Cl-、HCO3- |
| B、H+、Na+、Cu2+、SO42- |
| C、H+、Mg2+、SO42-、Cl- |
| D、H+、Fe2+、NO3-、K+ |
下列说法正确的是( )
| A、放热反应的发生均无需加热 |
| B、化学反应中能量变化的大小与反应物的质量多少无关 |
| C、1H、2H、3H、35Cl、37Cl中共有5种核素 |
| D、O2与O3的相互转化是物理变化 |
下列说法不正确的是( )
| A、霾的形成与PM2.5有直接关系 |
| B、自行车钢架生锈主要是电化学腐蚀所致 |
| C、用加热的方法杀死H7N9禽流感病毒是采用了蛋白质变性原理 |
| D、人类在研究物质微观结构的过程中,扫描隧道显微镜、光学显微镜、电子显微镜先后得到了使用 |

 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: