题目内容
5.人们对原子结构的认识有一个不断深化的过程,下列先后顺序中符合史实的是( )①道尔顿提出的原子论;②卢瑟福的原子结构行星模型;
③玻尔的原子轨道模型;④汤姆生提出的葡萄干面包原子模型.
| A. | ①④②③ | B. | ③①④② | C. | ③②①④ | D. | ③①②④ |
分析 ①1808年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出原子结构行星模型;
③1913年波尔提出的量子力学模型;
④1904年汤姆孙提出的葡萄干面包原子模型.
解答 解:①1808年,英国科学家道尔顿提出了原子论;
②1911年卢瑟福提出原子结构行星模型;
③1913年波尔提出的量子力学模型;
④1904年汤姆孙提出的葡萄干面包原子模型,先后顺序是①④②③.
故选A.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
16. 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液
反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,下列试剂中最好的是B (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
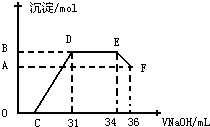
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-=H2O
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-=NH3•H2O
上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B点对应的沉淀的物质的量为0.032molmol,C点对应的氢氧化钠溶液的体积为7mL.
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液
反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)实验室溶解该熔融物,下列试剂中最好的是B (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为H++OH-=H2O
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为NH4++OH-=NH3•H2O
上述现象说明溶液中Al3+、Fe3+、H+结合OH-的能力比NH4+强(填离子符号).
(3)B点对应的沉淀的物质的量为0.032molmol,C点对应的氢氧化钠溶液的体积为7mL.
13.食品卫生与身体健康密切相关,下列做法对人体无害的是( )
| A. | 在沥青公路上翻晒粮食 | |
| B. | 用生活用煤直接烧烤鸡、鸭 | |
| C. | 用小苏打作发酵粉做面包 | |
| D. | 香肠中加过量亚硝酸钠以保存肉类新鲜 |
20.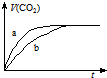 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
 现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )
现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100mL、1mol•L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示.有关说法正确的是( )| A. | 两份大理石一定有剩余 | |
| B. | 两份盐酸一定反应完全 | |
| C. | 曲线a表示的是块状大理石样品与盐酸反应 | |
| D. | 曲线b表示的是块状大理石样品与盐酸反应 |
10.现有几种元素的性质或原子结构如下表:
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是${\;}_6^{12}$C.
(2)画出T的离子结构示意图 .
.
(3)写出实验室制取Y单质的化学方程式2KMnO4$\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)Z的三种同位素原子名称氕、氘、氚.
(5)写出由T、X和Y三种元素组成的一种化合物在水溶液中的电离方程式NaClO=Na++ClO-.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 阳离子就是一个质子 |
(2)画出T的离子结构示意图
 .
.(3)写出实验室制取Y单质的化学方程式2KMnO4$\frac{\underline{\;加热\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)Z的三种同位素原子名称氕、氘、氚.
(5)写出由T、X和Y三种元素组成的一种化合物在水溶液中的电离方程式NaClO=Na++ClO-.
14.根据下列两个反应判断:2Cu+O2=2CuO,2Cu+S=Cu2S,下列叙述中错误的是( )
| A. | 硫和氧气反应中作氧化剂 | B. | 氧气的氧化性比硫强 | ||
| C. | 硫的氧化性比氧气强 | D. | 铜是一种具有可变化合价的元素 |
15.下列各物质中属于纯净物的是( )
| A. | 漂白粉 | B. | Na2CO3 | C. | 氯水 | D. | 液氨 |