题目内容
10.下列对于硝酸的认识,不正确的是( )| A. | 浓硝酸在见光或受热时会发生分解 | B. | 金属与硝酸反应不产生氢气 | ||
| C. | 可用铁和铝制品盛装浓硝酸 | D. | 铜与硝酸的反应属于置换反应 |
分析 A.浓硝酸不稳定,在见光或受热时分解生成二氧化氮、氧气和水;
B.硝酸具有强氧化性,能被金属还原生成氮的化合物;
C.常温下,浓硝酸和Fe、Al发生钝化现象;
D.铜和硝酸反应生成硝酸铜、氮氧化物和水.
解答 解:A.浓硝酸不稳定,在见光或受热时分解生成二氧化氮、氧气和水,反应方程式为4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+4NO2↑+O2↑,故A正确;
B.硝酸具有强氧化性,能被金属还原生成氮的化合物,没有H2生成,故B正确;
C.常温下,浓硝酸和Fe、Al发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以可用铁和铝制品盛装浓硝酸,故C正确;
D.铜和硝酸反应生成硝酸铜、氮氧化物和水,没有单质生成,不属于置换反应,故D错误;
故选D.
点评 本题考查硝酸性质,为高频考点,硝酸具有不稳定性、强氧化性特点,无论浓稀硝酸和金属反应都不生成氢气而生成氮的化合物,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
20.下列反应的离子方程式的书写正确的是( )
| A. | 镁粉与稀醋酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+OH-═Cl-+ClO-+H2O |
18.能正确表示下列反应的离子方程式是( )
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 实验室制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
5.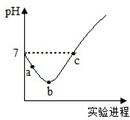 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
室温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| C. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| D. | 由a点到b点的过程中,溶液中$\frac{c(Cl{O}^{-})}{c({H}^{+})}$增大 |
15.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q).
已知:①C7H8(l)(NBD)+9O2(g)═7CO2(g)+4H2O(g);△H1;
②C7H8(l)(Q)+9O2(g)═7CO2(g)+4H2O(l);△H2;
③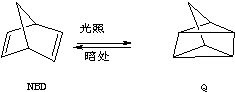 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1
下列叙述不正确的是( )
已知:①C7H8(l)(NBD)+9O2(g)═7CO2(g)+4H2O(g);△H1;
②C7H8(l)(Q)+9O2(g)═7CO2(g)+4H2O(l);△H2;
③
 ;△H=+88.62kJ•mol-1
;△H=+88.62kJ•mol-1下列叙述不正确的是( )
| A. | △H1>△H2 | B. | 等质量NBD的能量比Q的能量高 | ||
| C. | NBD比Q稳定 | D. | NBD转化为Q是吸热反应 |
2.在实验室中不宜用硫酸制备( )
| A. | 氢气 | B. | 二氧化碳 | C. | 氯化氢 | D. | 硫化氢 |

 .
. .
. ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.