题目内容
7.如何把铜粉和氧化铜粉末分离?分析 氧化铜可与盐酸反应,反应后的溶液加入过量氢氧化钠生成氢氧化铜沉淀,加热沉淀分解又可生成氧化铜.
解答 解:铜与盐酸不反应,为不活泼金属,可加入盐酸,氧化铜可与盐酸反应,发生CuO+2HCl═CuCl2+H2O,反应后的溶液加入过量氢氧化钠生成氢氧化铜沉淀,发生CuCl2+2NaOH═Cu(OH)2↓+2NaCl,过滤,将滤渣加热沉淀分解又可生成氧化铜,发生Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O,
答:将混合物滴入盐酸后过滤(CuO+2HCl═CuCl2+H2O);将滤液加入NaOH溶液生成沉淀滤出〔CuCl2+2NaOH═Cu(OH)2↓+2NaCl〕将滤渣加热即得到CuO〔Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O〕.
点评 本题考查混合物的分离,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
相关题目
19.已知反应:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,下列说法正确的是( )
| A. | H2的燃烧热(△H)是285.8kJ•mol-1 | |
| B. | 反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)是571.6kJ•mol-1 | |
| C. | 反应2H2O(l)=2H2(g)+O2(g)只能在电解条件下进行 | |
| D. | 反应2H2O(l)=2H2(g)+O2(g)在一定条件下可以自发进行 |
18.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
15.常温下,下列溶液中有关物质的量浓度关系不正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液等体积混合后pH<7,则HA为弱酸 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| C. | 物质的量浓度均为0.2mol•L-1CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.2mol•L-1 | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
2.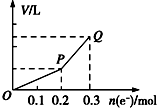 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.15 mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.075mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
19.等质量的两份铝粉分别与足量的稀NaOH溶液和稀硫酸反应,若消耗两溶液的体积相等,则两溶液的物质的量浓度之比是( )
| A. | 1:2 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
17.下列有关物质燃烧现象的叙述中,正确的是( )
| A. | 铁丝在氧气中燃烧:火星四射,生成红色固体 | |
| B. | 硫粉在空气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 | |
| C. | 镁条在空气中燃烧:发出耀眼的白光,只生成一种黑色固体 | |
| D. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 |

