题目内容
16.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0

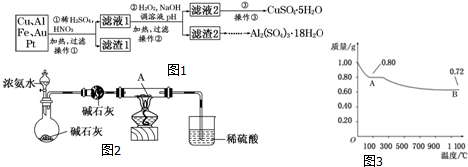
(1)如用图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体.制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中.当悬浮物较多时,停止制备.
注:四氯化碳与液体石蜡均为惰性介质.
(2)发生器用冰水冷却的原因是降低温度,提高反应物转化率.
(3)液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例.
(4)从反应后的混合物中分离出产品的实验方法是过滤;(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(5)尾气处理装置如图2所示.双通玻璃管的作用防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解.
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80%.(精确到2位小数)
分析 (1)装置1是利用分液漏斗滴入液体溶解锥形瓶中的固体,利用溶解放热使氨水分解生成氨气;
(2)反应是放热反应降温平衡正向进行;
(3)液体石蜡鼓泡瓶的主要作用是控制反应进行程度,控制气体流速和原料气体的配比;
(4)生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解;
(5)依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸;
(6)碳酸氢铵的氨基甲酸铵样品中,使碳元素完全转化为碳酸钙,依据碳元素守恒和混合物质量计算物质的量分数.
解答 解:(1)把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热使浓氨水分解生成氨气,故答案为:浓氨水与生石灰或氢氧化钠固体等;
(2)反应2NH3(g)+CO2(g)?NH2COONH4(s)+Q,是放热反应,降温平衡正向进行,温度升高;发生器用冰水冷却提高反应物质转化率,防止生成物温度过高分解,
故答案为:降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
(3)液体石蜡鼓泡瓶的作用是控制反应进行程度,控制气体流速和原料气体的配比,故答案为:通过观察气泡,调节NH3与CO2通入比例;
(4)制备氨基甲酸铵的装置如图3所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中,分离产品的实验方法利用过滤得到,氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、不能加热烘干,应在真空40℃以下烘干,故答案:过滤;c;
(5)双通玻璃管的作用是防止液体倒吸;浓硫酸起到吸收多余的氨气,同时防止空气中水蒸气进入反应器使氨基甲酸铵水解,
故答案为:防止倒吸;吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.物质的量为0.010mol,设样品中氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,依据碳元素守恒得到;
x+y=0.01
78x+79y=0.7820
解得x=0.008mol
y=0.002mol
则样品中氨基甲酸铵的物质的量分数=$\frac{0.008mol}{0.01mol}$×100%=80%,故答案为:80%.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,有关混合物的计算,题目难度中等.

| A. | 常温下,23g乙醇和甲酸的混合物中含有O-H键的数目为0.5NA | |
| B. | 40g SiC中含有Si-C键的数目为2NA | |
| C. | 标准状况下,22.4L乙醛含有分子的数目为NA | |
| D. | 2mol亚油酸(9,12-十八碳二烯酸,C17H31COOH)中含有双键的数目是4NA |
 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾霾形成的原因.(1)汽车尾气净化的主要原理为;2N0(g)+2C0(g)$\stackrel{催化剂}{?}$N2(g)+2C02(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1mol CO2的同时消耗了lmol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强、向容器中充入CO气体.(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3•mol-1
①该反应在高温下能自发进行(填“高温”或“低温,’).
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1═9.1×10-18;Ka2═1.1×10-12,H2CO3:Ka1═4.3×10-7;Ka2═5.6×10-11.)
(3)已知反应:CO(g)+H20(g)?CO2(g)+H2(g),现将不同量的CO(g)和H20(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
③该反应的△H<0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加人l0mol C0,5mo1H20,2mo1C02,5mol H2,则此时V正<V逆(填“<”,“>”,“=”).

 如图所示,
如图所示,