题目内容
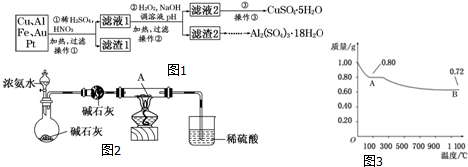
18.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
分析 由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平书写方程式;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3;
(3)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH;
阳离子交换膜防止锰酸根进入阴极区被还原.
解答 解:由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平后方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,有关反应离子方程式为3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH,电解反应方程式为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH,故A溶液应为KOH溶液;
阳离子交换膜防止锰酸根进入阴极区被还原,提高了Mn元素利用率,
故答案为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查实验制备方案,涉及化学工艺流程、仪器与试剂选择、对实验条件的控制、电解应用、对题目信息获取与应用等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,难度中等.

 精英口算卡系列答案
精英口算卡系列答案| A. | 铜与浓硫酸反应放出SO2:Cu+4H++SO42-═Cu2++SO2↑+2H2O | |
| B. | 加热NH4Cl和氢氧化钠固体混合物:NH4++OH-═NH3↑+H2O | |
| C. | 稀硝酸与过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2 H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+═2Fe3++2Cl- |
(一)制备苯甲酸乙酯
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用(通过形成水-乙醇-环己烷三元共沸物)带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品
(7)本实验中下列药品不能代替氢氧化铜使用的是D
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
| A. | “春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | Na2O2、Al2O3、C4H10分别属于碱性氧化物、两性氧化物和离子化合物 | |
| D. | 煤的气化、石油的分馏分别是化学变化、物理变化 |
| A. | 常温下,23g乙醇和甲酸的混合物中含有O-H键的数目为0.5NA | |
| B. | 40g SiC中含有Si-C键的数目为2NA | |
| C. | 标准状况下,22.4L乙醛含有分子的数目为NA | |
| D. | 2mol亚油酸(9,12-十八碳二烯酸,C17H31COOH)中含有双键的数目是4NA |
 .
. .
. .
.