题目内容
18.有四种短周期元素.它们的结构、性质等信息如表所述:| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的 某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置是第3周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
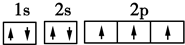 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.(4)D原子的外围电子排布式为3s23p5,D-的结构示意图是
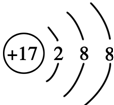 .
.(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O;B的最高价氧化物对应的水化物与D的氢化物的水溶液反应的化学方程式为3HCl+Al(OH)3═AlCl3+3H2O.
分析 A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,即处于第三周期,B的最高价氧化物的水化物呈两性,故B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂,则D为Cl.
解答 解:A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,即处于第三周期,B的最高价氧化物的水化物呈两性,故B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂,则D为Cl.
(1)A为Na,原子核外电子数为11,原子的核外电子排布式为:1s22s22p63s1,
故答案为:1s22s22p63s1;
(2)B为Al,元素在周期表中的位置是:第3周期第ⅢA族,钠离子、铝离子核外电子层结构相同,核电荷数越大离子半径越小,故铝离子半径小于钠离子比较,
故答案为:第3周期第ⅢA族;小于;
(3)C为N元素,核外电子排布式为:1s22s22p3,原子的电子排布图是 ,其原子核外2p轨道有3个未成对电子,p轨道的电子能量最高,轨道呈纺锤形,
,其原子核外2p轨道有3个未成对电子,p轨道的电子能量最高,轨道呈纺锤形,
故答案为: ;3;p;纺锤;
;3;p;纺锤;
(4)D为Cl元素,原子的外围电子排布式为3s23p5,Cl-的结构示意图是: ,故答案为:3s23p5;
,故答案为:3s23p5; ;
;
(5)A、B的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应方程式为:NaOH+Al(OH)3═NaAlO2+2H2O,氢氧化铝与盐酸反应生成氯化铝与水,反应方程式为:3HCl+Al(OH)3═AlCl3+3H2O,
故答案为:NaOH+Al(OH)3═NaAlO2+2H2O;3HCl+Al(OH)3═AlCl3+3H2O.
点评 本题考查结构性质位置关系应用,侧重对核外电子排布规律的考查,难度不大,注意对基础知识的理解掌握.

| A. | 氯气的分子式 Cl | B. | 钠原子的结构示意图 | ||
| C. | N2的电子式:N:::N: | D. | NaCl的电子式 Na+:Cl: |
| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 氢氧化钠溶液 |
| A. | 109 | B. | 118 | C. | 136 | D. | 137 |
| A. | HCl 和NaOH | B. | Na2O 和Na2O2 | C. | CaCl2 和 Na2S | D. | CO2 和 CaO |
| A. | O2和O3 | B. | 4019K与4020Ca | C. | T2O与D2O | D. | 21H和31H |
| A. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| B. | 某元素一种同位素原子的质子数为m,中子数为n.则这种元素的相对原子质量为m+n | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 仅由两种元素形成的共价化合物中可以同时含有极性共价键和非极性共价键强 |
