题目内容
13.某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13.在标准状况下,将50.0L混合通入足量溴水,溴水质量增重31.2g,通过计算回答:(1)混合气体中气态烷烃的化学式CH4.
(2)混合气体中烷烃与烯烃的物质的量之比3:1(写出简整数比).
(3)写出混合气态烯烃可能的结构简式CH2=CH-CH2CH3,CH3-CH=CH-CH3,CH2=C(CH3)2.
分析 相同条件下,密度之比等于相对分子质量之比,混合气体对氢气的相对密度为13,则混合气体的平均相对分子质量为26,故一定含有甲烷,根据n=$\frac{V}{{V}_{m}}$计算50L混合气体的物质的量,再根据m=nM计算混合气体的质量,溴水质量增重31.2g为烯烃的质量,进而计算甲烷的质量与物质的量,计算甲烷、烯烃的体积,相同条件下物质的量之比等于其体积之比,结合平均相对分子质量计算烯烃的相对分子质量,再根据烯烃的组成通式确定烯烃的分子式,进而书写可能的结构.
解答 解:(1)在同温同压下,混合气体对氢气的相对密度为13,故混合气体的平均相对分子质量为13×2=26,烯烃中乙烯的相对分子质量最小为28,故一定含有甲烷,
故答案为:CH4;
(2)标况下50L混合气体的物质的量为$\frac{50L}{22.4L/mol}$=$\frac{50}{22.4}$mol,故混合气体的总质量为$\frac{50}{22.4}$mol×26g/mol=58g,溴水质量增重31.2g为烯烃的质量,故甲烷的质量为58g-31.2g=26.8g,故甲烷的物质的量为$\frac{26.8}{16g/mol}$=1.675mol,则甲烷的体积为1.675mol×22.4L/mol≈37.5L,则烯烃的体积为50L-37.5L=12.5L,故混合气体中烷烃与烯烃的物质的量之比=37.5L:12.5L=3:1,
故答案为:3:1;
(3)设烯烃的相对分子质量为y,则:
$\frac{16×3+y}{3+1}$=26,解得y=56,
令烯烃的组成为(CH2)n,故14n=56,解得n=4,故该烯烃为C4H8,可能的结构为:CH2=CH-CH2CH3,CH3-CH=CH-CH3,CH2=C(CH3)2,
故答案为:CH2=CH-CH2CH3,CH3-CH=CH-CH3,CH2=C(CH3)2.
点评 本题考查有机物的分子式的确定、混合物计算、同分异构体等,题目数据处理复杂,属于易错题目,根据平均相对分子质量确定含有甲烷是解题的关键.

 下表给出五种短周期元素的相关信息.
下表给出五种短周期元素的相关信息.| 元素 | 相关信息 |
| A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
(1)D元素核外电子排布
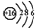 ;
;(2)A、B两元素形成的含有非极性键的化合物的结构式H-O-O-H;A、B两元素形成的具有相同电子数的离子有(填化学式):OH-、H3O+.
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:2N2H4+N2O4═3N2+4H2O.
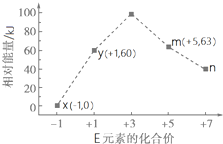
(4)一定条件下,在水溶液中1mol E-、EO${\;}_{x}^{-}$(x=1,2,3,4)的能量(kJ)相对大小如右图所示.n是ClO4-(填离子符号).离子反应y→x+m的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1(用离子符号表示).
(5)Na2DB3水溶液中各离子浓度的大小顺序是Na+>SO32->OH->HSO3->H+(填离子符号)
| A. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| B. | HXO4、H2YO4、H3ZO4一定都是强酸 | |
| C. | 元素的负化合价的绝对值按X、Y、Z减小 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序减弱 |
| A. | 除去甲烷中少量的乙炔:通入酸性高锰酸钾溶液,再通入氢氧化钠溶液洗气 | |
| B. | 除去乙烯中少量的乙烷:通入足量溴水中,然后洗气 | |
| C. | 除去乙烷中少量的乙烯:光照条件下通入氯气,然后气液分离 | |
| D. | 除去苯酚中少量的苯:加入足量的氢氧化钠溶液,分液后在通入足量二氧化碳 |
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的 某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式为1s22s22p63s1.
(2)B元素在周期表中的位置是第3周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
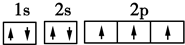 ,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.
,其原子核外有3个未成对电子,能量最高的电子为p轨道上的电子,其轨道呈纺锤形.(4)D原子的外围电子排布式为3s23p5,D-的结构示意图是
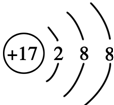 .
.(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为NaOH+Al(OH)3═NaAlO2+2H2O;B的最高价氧化物对应的水化物与D的氢化物的水溶液反应的化学方程式为3HCl+Al(OH)3═AlCl3+3H2O.
| A. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| B. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| C. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态 | |
| D. | 凡是分解反应都是吸热反应,化合反应都是放热反应 |
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.(1)居民使用的管道煤气主要成分是H2、CO和少量CH4,H2、CO和CH4的燃烧热(注:燃烧热是指在25℃,101kPa时,1mol可燃物质完全燃烧生成稳定的氧化物时所放出的热量,单位为kJ/mol.)数据如表:
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
(2)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将减小(填“增大”“减小”或“不变”).
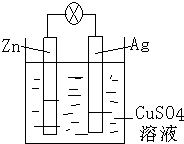
(3)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液.回答下列问题:
锌为负极,该电极上发生氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,该原电池的总反应离子方程式为Zn+Cu2+=Cu+Zn2+.
| A. | 二氧化碳分子的电子式: | B. | HClO的结构式为 H-Cl-O | ||
| C. | 硅的原子结构示意图: | D. | 甲烷分子的比例模型: |