题目内容
14.下列说法正确的是( )| A. | 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)<c(Na+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 足量锌分别和等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,放出H2的速率不等 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
分析 A.混合溶液显酸性,则c(H+)>c(OH-),结合电荷守恒分析;
B.NaHA溶液的pH<7,可能是HA-的电离程度大于水解程度;
C.醋酸为弱酸,不能完全电离;
D.氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,溶液中c(Cl-)越大,c(Ag+)越小.
解答 解:A.混合溶液显酸性,则c(H+)>c(OH-),溶液中电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(CH3COO-)>c(Na+),故A错误;
B.NaHA溶液的pH<7,可能是HA-的电离程度大于水解程度,所以H2A可能是弱酸,故B错误;
C.醋酸为弱酸,不能完全电离,等体积、等物质的量浓度的盐酸和醋酸反应时产生H2的量相等,但反应的速率不等,故C正确;
D.氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,故D错误.
故选:C.
点评 本题考查强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离以及溶度积常数的应用,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
3.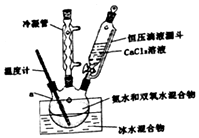 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:
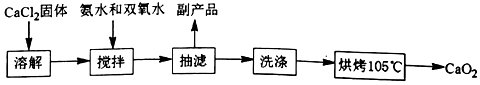
(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
已知:
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图、反应装置如图所示,请回答下列问题:
实验步骤:

(1)仪器a的名称三颈烧瓶;
(2)①沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少H2O2受热分解;降低氨的挥发;降低温度促使产物析出(写出两点)
②过滤后洗涤沉淀的试剂最好用B.
A.热水 B.冷水 C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由温度计应该为搅拌器.该反应需要不断搅拌,且冰水浴条件无需温度计.
(Ⅱ)产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol•L-1酸性高锰酸钾溶液滴定生成H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如表
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
①H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解.
②产品稳定性=$\frac{放置一个月后Ca{O}_{2}的质量分数}{放置前Ca{O}_{2}的质量分数}$×100%
(4)用KMnO4滴定,达到滴定终点时的现象是溶液由无色变淡紫色,且半分钟不褪色.
(5)该产品的“产品稳定性”=96%.
5.下列叙述正确的是( )
| A. | 某溶液中加入硝酸银溶液时,生成白色沉淀,说明溶液中有Cl- | |
| B. | 某溶液中加入稀硫酸溶液时,生成无色气体,说明溶液中有CO32- | |
| C. | 某溶液中加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- | |
| D. | 某溶液中加入盐酸溶液,无明显现象,再加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- |
19.室温下,下列关于pH均为9、体积均为10mL的NaOH溶液和CH3COONa溶液的说法正确的是( )
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加热到相同温度时,CH3COONa溶液的pH大 | |
| C. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| D. | 两溶液中由水电离出的c(OH-)之比为$\frac{1{0}^{-5}}{1{0}^{-9}}$ |
6.香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
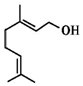

| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H20O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
3.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.1mol NaHCO3晶体中含有NA个CO32- | |
| B. | 标准状况下,11.2L的18O2中所含的中子数为8NA | |
| C. | 1mol Fe与足量的稀HNO3反应,转移电子数目为3NA | |
| D. | 标准状况下,22.4L苯中含有碳氢键数目为6NA |
4.在乙醇的化学性质中,各反应的断键方式不正确的是( )
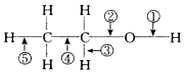

| A. | 与浓硫酸混合加热至170℃,断②⑤ | B. | 与氢卤酸反应断② | ||
| C. | 分子间脱水断①或② | D. | 与醋酸反应断② |
