题目内容
7.A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为65,中子数为35.请回答下列问题:(1)AY2是一种常用的溶剂,为非极性分子(填“极性”或“非极性”),分子中存在2个σ键.
(2)X形成的单质与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于原子晶体.
(3)X、氧、B元素的电负性由大到小的顺序为O>N>Al(用元素符号作答).
(4)Z的基态原子核外电子排布式为1s22s23s23p63d104s2.
分析 A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为5、中子数为35,则质子数=65-35=30,故Z为Zn元素,据此进行解答.
解答 解:A元素可形成自然界硬度最大的单质,该单质为金刚石,则A为C元素;B与A同周期,核外有三个未成对电子,则B为N元素;根据X原子的第一电离能至第四电离可知,X原子的第四电离能剧增,则X表现+3价,所以X为Al元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,则Y为S元素;Z的一种同位素的质量数为5、中子数为35,则质子数=65-35=30,故Z为Zn元素,
(1)AY2化学式是CS2,其结构式为S=C=S,为直线型结构,属于非极性分子,其分子中每个双键中含有1个σ键,所以CS2分子存在2个σ键,
故答案为:非极性;2;
(2)X是Al元素,铝与NaOH溶液反应生成偏铝酸钠和氢气,其离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
XB是CN,晶体与金刚石类似,属于原子晶体;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;原子;
(3)非金属性越强,电负性越强,Al、O、N元素的电负性与非金属性一致,则三种元素电负性大到小顺序为:O>N>Al,
故答案为:O>N>Al;
(4)Z为30号Zn元素,根据构造原理,其基态原子核外电子排布式为:1s22s2 3s23p63d104s2?,
故答案为:1s22s23s23p63d104s2.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据题干信息正确推断各元素名称为解答关键,侧重于考查学生的分析能力和对基础知识的综合应用能力.

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案①浊液 ②乳液 ③溶液 ④烟 ⑤雾 ⑥氢氧化铁胶体.
| A. | 只有⑥ | B. | ④⑤⑥ | C. | ①③⑤ | D. | 全部 |
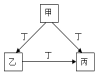 甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )
甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素.甲、乙、丙、丁之间的转化关系如图所示,则乙不可能是( )| A. | Al(OH)3 | B. | FeCl3 | C. | CO | D. | Na2CO3 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 若卤代烃的分子式为C4H9X,则RCH2X有5种结构 | |
| B. | 该反应是置换反应 | |
| C. | 反应过程中RCH2X是氧化剂 | |
| D. | 处理含1 mol卤代烃的废水时,转移4 mol电子 |
| A. | 任何分子或化合物都是通过原子间形成化学键相结合的 | |
| B. | 物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 分子的稳定性与化学键强弱有关 |
| A. | 1s22s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63s1 |
| A. | 往溶液中滴入0.2 mol•L-1的氨水 | B. | 往溶液中加入NH4Cl晶体 | ||
| C. | 往溶液中加入CH3COONa固体 | D. | 往溶液中加入NaOH固体 |
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1mol N2在一定条件下反应所得混合气体分子数小于2NA |