题目内容
16.室温下,往0.001mol•L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色.现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是( )| A. | 往溶液中滴入0.2 mol•L-1的氨水 | B. | 往溶液中加入NH4Cl晶体 | ||
| C. | 往溶液中加入CH3COONa固体 | D. | 往溶液中加入NaOH固体 |
分析 氨水中存在NH3•H2O?NH4++OH-,溶液呈弱碱性,如采取某些措施,滴有酚酞的氨水溶液颜色不会变浅,说明OH-离子浓度不减小,以此解答该题.
解答 解:NH3•H2O?NH4++OH-,滴入酚酞呈现粉红色,说明氨水的pH在8~10之间.
A.加入0.2 mol•L-1的氨水,氨水浓度增大,c(OH-)增大,红色变深,故A错误;
B.加入NH4Cl,c(NH4+)增大抑制了氨水的电离,c(OH-)减小颜色变浅,故B正确;
C.加入CH3COONa固体,CH3COO-水解产生OH-,c(OH-)增大,红色变深,故C错误;
D.加入NaOH固体,对氨水的电离平衡产生抑制作用,但c(OH-)变大,红色变深,故D错误.
故选B.
点评 本题考查了弱电解质在溶液中的电离,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,题目多角度考查电离平衡,注意把握相关基础知识,难度不大.

练习册系列答案
相关题目
17.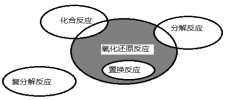 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )| A. | CuSO4+Mg=Cu+MgSO4 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
6.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子1100℃ | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |



