题目内容
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
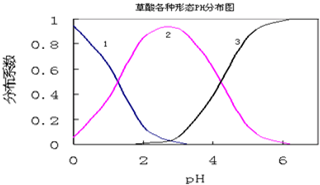
(1)图中曲线1表示 的分布系数变化;曲线3表示 的分布系数变化.
现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4③H2C2O4④(NH4)2C2O4⑤NH4HC2O4已知NaHC2O4溶液显酸性.
(2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是 (用离子方程式表示).
(3)常温下,向10mL 0.1mol/L H2C2O4溶液中滴加0.1mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显 性(填“酸”、“碱”或“中”),且V(NaOH) 10mL(填“>”、“=”或“<”).
(4)下列关于五种溶液的说法中,正确的是
A.溶液②中,c(C2O42-)<c(H2C2O4)
B.溶液②中,c(H2C2O4)+c(OH-)=c(C2O42-)+c(H+)
C.溶液④⑤中都符合c(NH4+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
D.五种溶液都符合c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol?L-1.
(5)五种溶液中c(H2C2O4)由大到小排列的顺序是 .
(6)配平氧化还原反应方程式:□C2O42-+□MnO4-+□H+=□CO2↑+□Mn2++□H2O
(7)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液用0.10mol/L 酸性KMnO4溶液滴定,滴定终点如何判断 .当加入16mL 0.10mol/L 酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4?2H2O的质量分数为 ,KHC2O4的质量分数为 .如果用0.25mol/L NaOH 溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数 (填“偏高”“偏低”或“无影响”)

(1)图中曲线1表示
现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4③H2C2O4④(NH4)2C2O4⑤NH4HC2O4已知NaHC2O4溶液显酸性.
(2)Na2C2O4溶液中,c(Na+)/c(C2O42-)
(3)常温下,向10mL 0.1mol/L H2C2O4溶液中滴加0.1mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显
(4)下列关于五种溶液的说法中,正确的是
A.溶液②中,c(C2O42-)<c(H2C2O4)
B.溶液②中,c(H2C2O4)+c(OH-)=c(C2O42-)+c(H+)
C.溶液④⑤中都符合c(NH4+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)
D.五种溶液都符合c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol?L-1.
(5)五种溶液中c(H2C2O4)由大到小排列的顺序是
(6)配平氧化还原反应方程式:□C2O42-+□MnO4-+□H+=□CO2↑+□Mn2++□H2O
(7)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.第二份溶液用0.10mol/L 酸性KMnO4溶液滴定,滴定终点如何判断
考点:酸碱混合时的定性判断及有关ph的计算,盐类水解的应用,中和滴定
专题:
分析:(1)pH越小,H2C2O4的浓度越大,pH越大,C2O42-越小;
(2)草酸钠中的草酸根离子是弱酸阴离子,C2O42-易水解,C2O42-的数目减少;
(3)根据电荷守恒确定溶液中氢离子和氢氧根离子浓度相对大小,从而确定溶液酸碱性;草酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量;
(4)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度;
B.溶液b中,存在电荷守恒和物料守恒;
C.任何溶液中都存在电荷守恒;
D.任何溶液中都存在物料守恒;
(5)草酸根离子水解程度大于草酸氢根离子,草酸是弱电解质,电离程度较小;
(6)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数,以此分析;
(7)溶液中H2C2O4、KHC2O4完全反应,滴加最后一滴高锰酸钾,颜色不褪去,溶液颜色由无色变为紫红色;
溶液由无色变为浅红色,溶液中H2C2O4、KHC2O4完全反应,根据n=cV计算NaOH的物质的量,结合反应本质OH-+H+=H2O计算被中和的H+的物质的量;
根据n=cV计算KMnO4的物质的量,根据方程式5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,计算还原剂H2C2O4、KHC2O4的总物质的量;
设出H2C2O4、KHC2O4的物质的量分别为xmol、ymol,然后列出方程组计算,进而计算原样品中各自质量分数.
(2)草酸钠中的草酸根离子是弱酸阴离子,C2O42-易水解,C2O42-的数目减少;
(3)根据电荷守恒确定溶液中氢离子和氢氧根离子浓度相对大小,从而确定溶液酸碱性;草酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量;
(4)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度;
B.溶液b中,存在电荷守恒和物料守恒;
C.任何溶液中都存在电荷守恒;
D.任何溶液中都存在物料守恒;
(5)草酸根离子水解程度大于草酸氢根离子,草酸是弱电解质,电离程度较小;
(6)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数,以此分析;
(7)溶液中H2C2O4、KHC2O4完全反应,滴加最后一滴高锰酸钾,颜色不褪去,溶液颜色由无色变为紫红色;
溶液由无色变为浅红色,溶液中H2C2O4、KHC2O4完全反应,根据n=cV计算NaOH的物质的量,结合反应本质OH-+H+=H2O计算被中和的H+的物质的量;
根据n=cV计算KMnO4的物质的量,根据方程式5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,计算还原剂H2C2O4、KHC2O4的总物质的量;
设出H2C2O4、KHC2O4的物质的量分别为xmol、ymol,然后列出方程组计算,进而计算原样品中各自质量分数.
解答:
解:(1)根据图象知,溶液的pH越小,草酸的浓度越大,pH越大,C2O42-的越大,所以曲线1为草酸,图3为C2O42-,故答案为:H2C2O4;C2O42-;
(2)草酸钠中的草酸根离子是弱酸阴离子,C2O42-易水解:C2O42-+H2O?HC2O4-+OH-,所以草酸钠溶液中,c(Na+)/c(C2O42-)>2,
故答案为:>;C2O42-+H2O?HC2O4-+OH-;
(3)根据电荷守恒得c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),c(Na+)=2c(C2O42-)+c(HC2O4-),则c(H+)=c(OH-),所以溶液呈中性;
酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以氢氧化钠溶液的体积V(NaOH)>10mL,
故答案为:中;>;
(4)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B.NaHC2O4溶液中,存在电荷守恒和物料守恒,根据物料守恒得c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),根据电荷守恒得c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),所以得c(H+)+c(H2C2O4)=2c(C2O42-)+c(OH-),故B错误;
C.任何溶液中都存在电荷守恒:c(NH4+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C正确;
D.任何溶液中都存在物料守恒,根据物料守恒得:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol?L-1,故D正确;
故答案为:CD;
②草酸根离子水解程度大于草酸氢根离子、铵根离子促进草酸根离子或草酸氢根离子水解,草酸电离程度较小,所以五种溶液中的c(H2C2O4)由大到小排列的顺序为:③>⑤>②>④>①,
故答案为:③>⑤>②>④>①;
(6)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,一得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数=10,由电子守恒和原子守恒可知,配平后的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,
故答案为:5;2;16;10;2;8;
(7)溶液中H2C2O4、KHC2O4完全反应,滴加最后一滴高锰酸钾,颜色不褪去,溶液颜色由无色变为紫红色;
溶液由无色变为浅红色,溶液中H2C2O4、KHC2O4完全反应,消耗NaOH的物质的量=0.02L×0.25mol/L=0.005mol,结合反应本质OH-+H+=H2O可知被中和的H+的物质的量为:n(NaOH)=0.005mol,
消耗KMnO4的物质的量为:0.016L×0.1mol/L=0.0016mol,根据方程式5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O可知还原剂H2C2O4、KHC2O4的总物质的量为:0.0016mol×
=0.004mol,
设25mL溶液中H2C2O4、KHC2O4的物质的量分别为xmol、ymol,则:
H2C2O4~2NaOH KHC2O4~NaOH
xmol 2xmol ymol ymol
由题意可知:
,
解得:x=0.001、y=0.003,
故原样品中H2C2O4?2H2O的质量分数为:
×100%=21%;
KHC2O4的质量分数为:
×100%=64%;
如果用0.25mol/L NaOH溶液滴定第一份溶液的实验滴定终点仰视读数,导致消耗的氢氧化钠溶液体积偏大,计算出的KHC2O4的物质的量偏小,则测得的KHC2O4的质量分数偏低,
故答案为:当一滴高锰酸钾溶液加入时溶液有无色变为紫红色,且30秒内无变化;21%;64%;偏低.
(2)草酸钠中的草酸根离子是弱酸阴离子,C2O42-易水解:C2O42-+H2O?HC2O4-+OH-,所以草酸钠溶液中,c(Na+)/c(C2O42-)>2,
故答案为:>;C2O42-+H2O?HC2O4-+OH-;
(3)根据电荷守恒得c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),c(Na+)=2c(C2O42-)+c(HC2O4-),则c(H+)=c(OH-),所以溶液呈中性;
酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠应该稍微过量,所以氢氧化钠溶液的体积V(NaOH)>10mL,
故答案为:中;>;
(4)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故A错误;
B.NaHC2O4溶液中,存在电荷守恒和物料守恒,根据物料守恒得c(Na+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),根据电荷守恒得c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),所以得c(H+)+c(H2C2O4)=2c(C2O42-)+c(OH-),故B错误;
C.任何溶液中都存在电荷守恒:c(NH4+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C正确;
D.任何溶液中都存在物料守恒,根据物料守恒得:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol?L-1,故D正确;
故答案为:CD;
②草酸根离子水解程度大于草酸氢根离子、铵根离子促进草酸根离子或草酸氢根离子水解,草酸电离程度较小,所以五种溶液中的c(H2C2O4)由大到小排列的顺序为:③>⑤>②>④>①,
故答案为:③>⑤>②>④>①;
(6)反应中MnO4-→Mn2+,Mn元素由+7价→+2价,一得5个电子;C2O42-→CO2,C元素由+3价→+4价,一个C2O42-失去2个电子,化合价升高值=化合价降低值=转移电子数=10,由电子守恒和原子守恒可知,配平后的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,
故答案为:5;2;16;10;2;8;
(7)溶液中H2C2O4、KHC2O4完全反应,滴加最后一滴高锰酸钾,颜色不褪去,溶液颜色由无色变为紫红色;
溶液由无色变为浅红色,溶液中H2C2O4、KHC2O4完全反应,消耗NaOH的物质的量=0.02L×0.25mol/L=0.005mol,结合反应本质OH-+H+=H2O可知被中和的H+的物质的量为:n(NaOH)=0.005mol,
消耗KMnO4的物质的量为:0.016L×0.1mol/L=0.0016mol,根据方程式5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O可知还原剂H2C2O4、KHC2O4的总物质的量为:0.0016mol×
| 5 |
| 2 |
设25mL溶液中H2C2O4、KHC2O4的物质的量分别为xmol、ymol,则:
H2C2O4~2NaOH KHC2O4~NaOH
xmol 2xmol ymol ymol
由题意可知:
|
解得:x=0.001、y=0.003,
故原样品中H2C2O4?2H2O的质量分数为:
0.001mol×
| ||
| 6g |
KHC2O4的质量分数为:
0.003mol×
| ||
| 6g |
如果用0.25mol/L NaOH溶液滴定第一份溶液的实验滴定终点仰视读数,导致消耗的氢氧化钠溶液体积偏大,计算出的KHC2O4的物质的量偏小,则测得的KHC2O4的质量分数偏低,
故答案为:当一滴高锰酸钾溶液加入时溶液有无色变为紫红色,且30秒内无变化;21%;64%;偏低.
点评:本题考查了离子浓度大小比较、中和滴定的计算等知识,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列化学实验事实及其解释都正确的是( )
| A、滴有酚酞的碳酸氢钠溶液呈浅红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠 |
| B、粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C、用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应 |
| D、向溴水中滴入裂解汽油,振荡后,油层显无色,说明溴不溶于裂解汽油 |
在第二次世界大战中拯救了成千上万士兵的生命,被誉为与原子弹、雷达齐名的当时三大发明之一的药物是( )
| A、青霉素 | B、阿司匹林 |
| C、麻黄碱 | D、抗酸药 |
足球运动员在比赛中腿部受伤后常喷洒一种液体物质,使受伤部位皮肤表面温度骤然下降,减轻伤员疼痛感,这种物质是( )
| A、碘酒 | B、氟利昂 |
| C、氯乙烷 | D、酒精 |
将浸湿了溴水的棕红色滤纸,挂在含二氧化硫的容器里,滤纸褪色了,这是因为( )
| A、二氧化硫具有漂白性 |
| B、溴挥发而褪色 |
| C、二氧化硫具有还原性 |
| D、溴被还原成Br- |
常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是( )
| A、将0.2mol?L-1的某一元酸HA溶液和0.1mol?L-1NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| B、某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)=c(Na+) |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,若a>7时,则该溶液的pH一定为14-a |
下列各项中与有机物种类、数目繁多没有关系的是( )
| A、每个碳原子能与其它的原子(或碳原子)形成四条共价键 |
| B、大多数原子组成完全相同的分子具有不同的结构 |
| C、碳原子间可以形成单键、双键和叁键 |
| D、碳单质性质稳定 |