题目内容
下列关于NH4Cl溶液的叙述中,正确的是( )
| A、c(NH4+)>c(Cl-) |
| B、c(NH4+)<c(Cl-) |
| C、c(NH4+)=c(Cl-) |
| D、不能确定c(NH4+)与c(Cl-)的大小 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:氯化铵为强酸弱碱盐,铵根离子水解而使其溶液呈酸性,再结合电荷守恒判断铵根离子和氯离子浓度相对大小.
解答:
解:氯化铵为强酸弱碱盐,铵根离子水解而使其溶液呈酸性,c(H+)>c(OH-),溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),所以c(NH4+)<c(Cl-),
故选B.
故选B.
点评:本题考查了盐类水解,根据盐的类型确定盐溶液的酸碱性,再结合电荷是判断即可,难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
常温下,将一定浓度的某一元酸HA和0.1mol?L-1NaOH溶液等体积混合后,下列说法正确的是( )
| A、若pH=7,HA的浓度一定为0.1 mol?L-1 |
| B、若pH=7,A-的浓度可能小于Na+的浓度 |
| C、若pH<7,溶液中的微粒浓度关系为[Na+]=[HA]+[A-] |
| D、若pH=12,且HA为强酸时,HA的浓度应为0.08 m01.L-1 |
常温下,下列溶液中各组离子一定大量共存的是( )
| A、使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、CO32- |
| B、c(ClO-)=1.0 mol?L-1溶液:Na+、SO32-、S2-、Cl- |
| C、含有0.1 mol?L-1 HCO3-的溶液:Na+、Fe3+、NO3-、C6H5O- |
| D、c(OH-)=0.1 mol?L-1的溶液:Na+、K+、CO32-、NO3- |
“天宫一号”放电充电所用镍氢蓄电池(Ni-MH、KOH作为电解液)的总反应为:NiOOH+MH
Ni(OH)2+M(M表示储氢合金,MH表示吸附了氢原子的储氢合金),下列叙述正确的是( )
| ||
| 充电 |
| A、放电时,正、负极附近溶液pH不变 |
| B、放电时正极材料为MH,发生氧化反应 |
| C、充电时阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O |
| D、放电时,每转移1mol电子,负极有1 mol NiOOH被还原 |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
A、 可用于分离苯和硝基苯的混合物 |
B、 可用于吸收HCl气体.并防止倒吸 |
C、 可用于以NH4Cl为原料,实验室制取NH3 |
D、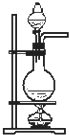 可用于实验室制取乙烯 |


