题目内容
“天宫一号”放电充电所用镍氢蓄电池(Ni-MH、KOH作为电解液)的总反应为:NiOOH+MH
Ni(OH)2+M(M表示储氢合金,MH表示吸附了氢原子的储氢合金),下列叙述正确的是( )
| ||
| 充电 |
| A、放电时,正、负极附近溶液pH不变 |
| B、放电时正极材料为MH,发生氧化反应 |
| C、充电时阳极反应:Ni(OH)2+OH--e-=NiOOH+H2O |
| D、放电时,每转移1mol电子,负极有1 mol NiOOH被还原 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:放电时负极上MH失电子发生氧化反应,电极反应式为MH+OH--e-═M+H2O,正极上NiOOH得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,结合电极方程式计算.
解答:
解:A.放电时正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,所以正极附近溶液的碱性增强,pH增大,而负极电极反应式为MH+OH--e-═M+H2O,消耗OH-,pH减小,故A错误;
B.正极上NiOOH得电子发生还原反应,故B错误;
C.充电时阳极失电子发生氧化反应,电极方程式为Ni(OH)2+OH--e-=NiOOH+H2O,故C正确;
D.放电时,每转移1mol电子,正极有1mol NiOOH被还原,故D错误.
故选C.
B.正极上NiOOH得电子发生还原反应,故B错误;
C.充电时阳极失电子发生氧化反应,电极方程式为Ni(OH)2+OH--e-=NiOOH+H2O,故C正确;
D.放电时,每转移1mol电子,正极有1mol NiOOH被还原,故D错误.
故选C.
点评:本题考查了原电池,根据电池反应式中元素化合价变化及原电池原理来分析解答,难度不大,注意把握原电池的工作原理以及电极方程式的书写,为解答该题的关键.

练习册系列答案
相关题目
下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是( )
| A、CH4O C3H4O5 |
| B、C3H6 C4H6O3 |
| C、C2H2 C6H6 |
| D、C3H8 C4H6 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
| A、由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al→Al3++3e- |
| B、由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al+4OH→-Al(OH)4-+3e- |
| C、由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu→Cu2++2e- |
| D、由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu→Cu2++2e- |
0.4molMnO2与100mL12mol/L盐酸混合后缓慢加热(不考虑HCl挥发)反应完全后所得溶液中加入足量AgNO3溶液,生成AgCl的物质的量( )
| A、等于0.8mol |
| B、小于0.8mol |
| C、大于0.6mol |
| D、等于0.6mol |
下列关于NH4Cl溶液的叙述中,正确的是( )
| A、c(NH4+)>c(Cl-) |
| B、c(NH4+)<c(Cl-) |
| C、c(NH4+)=c(Cl-) |
| D、不能确定c(NH4+)与c(Cl-)的大小 |
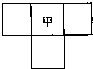 甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.
甲、乙、丙、丁四种短周期元素的位置如图(其中乙、丙、丁的位置未标出),已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等.