题目内容
17.检验居室中有甲醛气体,可连续多次抽取居室空气样品,注入到低浓度(1×10-4mol/L)的酸性高锰酸钾溶液中.据此,下列说法正确的是( )| A. | 最终酸性高锰酸钾溶液褪色 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 说明甲醛是具有氧化性的气体 |
分析 甲醛中含有醛基,具有还原性,能与高锰酸钾溶液反应使其褪色,据此解答即可.
解答 解:甲醛中含有醛基-CHO,具有还原性,能与高锰酸钾溶液反应使其褪色,此反应中甲醛被氧化,故选A.
点评 本题主要考查的是生活中常见有机化合物的性质,掌握甲醛具有还原性是解决本题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列反应的离子方程式书写正确的是( )
| A. | Fe0溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 明矾溶液中滴加过量氨水:Al3++3NH3.H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | 漂白粉溶液中通入S02:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| D. | 小苏打溶液中加足量澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ |
5.298K时,已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.3kJ•mol-1,平衡常数K=4.下列说法正确的是( )
| A. | 使用催化剂会使K变化但△H不变 | |
| B. | 使用催化剂会使△H增大,但K不变 | |
| C. | 使用催化剂和提高温度均可增大H2的转化率 | |
| D. | 在一密闭容器中,投入浓度均为1mol•L-1的 N2、H2、NH3,平衡前v(正)>v(逆) |
12.下列物质可以看做是纯净物的是( )
| A. | 河水 | B. | 海水 | C. | 蒸馏水 | D. | 农夫山泉矿泉水 |
2.氧族元素的各种性质可归纳整理出如表(部分):
回答下列问题:
(1)S2-的电子式为 .
.
(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)S2-的电子式为
 .
.(2)氧元素比硫元素非金属性强(填强或弱).请用化学方程式证明该结论:2H2S+O2=2S↓+2H2O.
6.实验室保存下列化学药品的方法不妥当的是( )
| A. | 将新制氯水保存在棕色试剂瓶中 | |
| B. | 将NaOH溶液保存在带玻璃塞的细口试剂瓶中 | |
| C. | 将少量钾、钠保存在煤油中 | |
| D. | 将浓硝酸溶液保存在棕色试剂瓶中 |
7.对于反应N2(g)+3H2O(g)═2NH3(g)+$\frac{3}{2}$O2(g),在不同时间段内所测反应速率见选项,则表示该化学反应进行最快的是( )
| A. | v(N2)=1.5 mol•(L•min)-1 | B. | v(NH3)=1.8 mol•(L•min)-1 | ||
| C. | v(H2O)=2.67 mol•(L•min)-1 | D. | v(O2)=1.5 mol•(L•min)-1 |
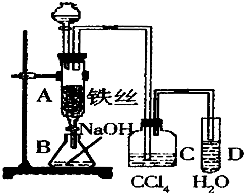 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.