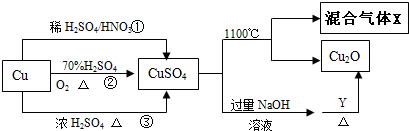
题目内容
7.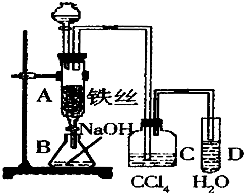 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.(1)写出A中有关反应的化学方程式2Fe+3Br2=2FeBr3;C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)观察到D中的现象是有雾状物质出现;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴;,写该化学方程式:Br2+2NaOH═NaBr+NaBrO+H2O;
(4)C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气和苯.
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液或石蕊试液,现象是产生淡黄色沉淀或溶液变红色则能证明.
分析 根据实验装置可知,将溴和苯的混合物滴入到铁丝上,在铁作催化剂的条件下苯和溴发生取代反应生成溴苯和溴化氢,溴和苯都是易挥发的物质,所以C装置中用四氯化碳吸收溴化氢气体中的苯和溴,生成的溴化氢用水吸收,注意要防止倒吸,所以导管口中液面上方,A中反应后的溶液放到B中,用氢氧化钠溶液除去溴苯中的溴,(1)铁与溴会生成溴化铁,苯和液溴在溴化铁催化作用下发生取代反应生成溴苯和溴化氫;
(2)溴化氢易溶于水,氢溴酸易挥发;
(3)溴能与氢氧化钠反应而溴苯不能;
(4)CCl4 能溶解溴不能溶解溴化氢;
(5)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.
解答 解:根据实验装置可知,将溴和苯的混合物滴入到铁丝上,在铁作催化剂的条件下苯和溴发生取代反应生成溴苯和溴化氢,溴和苯都是易挥发的物质,所以C装置中用四氯化碳吸收溴化氢气体中的苯和溴,生成的溴化氢用水吸收,注意要防止倒吸,所以导管口中液面上方,A中反应后的溶液放到B中,用氢氧化钠溶液除去溴苯中的溴,
(1)A中铁与溴会生成溴化铁,反应方程式为2Fe+3Br2=2FeBr3,在FeBr3的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为:2Fe+3Br2=2FeBr3;C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)由于溴化氢易溶于水,氢溴酸易挥发,所以D中可观察到有雾状物质出现,
故答案为:有雾状物质出现;
(3)溴单质能与氢氧化钠溶液反应而溴苯不能,反应方程式:Br2+2NaOH═NaBr+NaBrO+H2O,
故答案为:除去溶于溴苯中的溴;Br2+2NaOH═NaBr+NaBrO+H2O;
(4)CCl4 能溶解溴不能溶解溴化氢,四氯化碳能除去溴化氢气体中的溴蒸气和苯,
故答案为:除去溴化氢气体中的溴蒸气;
(5)如果苯和液溴发生的是取代反应,则有HBr生成,如果发生的是加成反应,则无HBr生成.也就是说,如果要证明苯和液溴发生的是取代反应,而不是加成反应,只需检验有无HBr生成.可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明发生取代反应,我们再回答出检验H+的方法即可,可用石蕊试液,若变红则发生取代反应.但溴易挥发,溴化氢气体中的溴蒸气对溴化氢的检验有干扰作用,因此,在检验溴化氢前必须除去溴蒸气,这也正是C中盛放的CCl4的作用,
故答案为:AgNO3溶液或石蕊试液;产生淡黄色沉淀或溶液变红色.
点评 本题考查苯的取代反应方程式及实验现象以及产物HBr的检验,题目难度中等,注意掌握苯的取代反应原理,明确反应的产物及HBr的化学性质进行解题.

| A. | 过量的铁与稀H2SO4反应 | B. | FeO与H2SO4反应 | ||
| C. | FeCO3与H2SO4稀反应 | D. | Fe(OH)3与稀H2SO4反应 |

步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)步骤1仪器a中发生的主要反应是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr(2)仪器d的作用是吸收HBr防污染防倒吸
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式)
(5)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
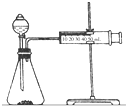 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| A. | Na2O2和Na2O都是白色固体,都能与冷水作用得到O2和NaOH | |
| B. | 在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 | |
| C. | 相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 | |
| D. | Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物 |
| A. | 最终酸性高锰酸钾溶液褪色 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 说明甲醛是具有氧化性的气体 |
 实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸.
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸. +NaOH→
+NaOH→ +
+
 (不容于醚,可溶于水)
(不容于醚,可溶于水)