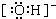题目内容
20.某原电池构造如图所示.下列有关叙述正确的是( )
| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
分析 A、该装置是原电池,铜作负极,银作正极,电子从负极沿导线流向正极;
B、只有能构成闭合回路才能有电流产生;
C、根据铜和电子的关系式计算;
D、该反应中铜和硝酸银反应生成银和硝酸铜.
解答 解:A、该装置是原电池,较活泼的金属铜作负极,银作正极,外电路中电子从铜沿导线流向银,故A错误;
B、取出盐桥后,不能构成闭合回路,所以没有电流产生,电流计的指针不能发生偏转故,故B错误;
C、铜极上的电极反应式为:Cu-2e-=Cu2+
64g 2mol
3.2g 0.1mol
所以外电路中每通过0.1mol电子,铜的质量理论上减小3.2g,故C错误;
D、该装置中负极上铜失电子,正极上银离子得电子,所以电池反应式为Cu+2AgNO3=2Ag+Cu(NO3)2,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,明确盐桥的作用、外电路中电子的流向、铜和电子的关系即可解答本题.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
13.几种有机化合物的结构简式如下:①CH3-CHO;② ;③
;③ ;④CH3COOC2H5;⑤
;④CH3COOC2H5;⑤ ;⑥
;⑥ ,有关上述有机化合物的类别叙述正确的是( )
,有关上述有机化合物的类别叙述正确的是( )
 ;③
;③ ;④CH3COOC2H5;⑤
;④CH3COOC2H5;⑤ ;⑥
;⑥ ,有关上述有机化合物的类别叙述正确的是( )
,有关上述有机化合物的类别叙述正确的是( )| A. | ①醛,②酚,③环烷烃,④酯,⑤羧酸,⑥酯 | |
| B. | ①醇,②酚,③芳香烃,④酚,⑤芳香烃,⑥羧酸 | |
| C. | ①醛,②醇,③芳香烃,④羧酸,⑤羧酸,⑥醛 | |
| D. | ①醛,②酚,③芳香烃,④酯,⑤羧酸,⑥羧酸 |
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热(△H)为-192.9kJ•mol-1 | |
| B. | 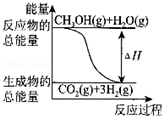 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
8. 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-=M+H2O+e- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
15.一定温度下,将 3mol SO2 和 1mol O2 充入一定容密闭容器中,在催化剂存 在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);当达到平衡状态时,下列说法中正确的是( )
| A. | 生成 SO3 为 2 mol | |
| B. | SO2 和 SO3 物质的量之和一定为 3 mol | |
| C. | 1molO2 恰好反应完 | |
| D. | SO2 的物质的量和 SO3 物质的量一定相等 |
12.下列离子方程式中正确的是( )
| A. | 氯气溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 硫酸氢钠溶液与氢氧化钡溶液混合至混合液呈中性:2HSO4-+Ba2++2OH-=BaSO4↓+2H2O+SO42- | |
| C. | 向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | |
| D. | 用铜作阳极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
10.能正确表示下列反应的离子方程式是( )
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
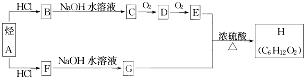
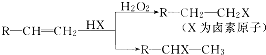
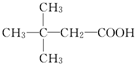 .(用结构简式表示)
.(用结构简式表示)