题目内容
8. 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-=M+H2O+e- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
分析 镍氢电池中主要为KOH作电解液充电时,阳极反应:Ni(OH)2+OH-=NiOOH+H2O+e-阴极反应:M+H2O+e-=MH+OH-,总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,负极:MH+OH--e-=M+H2O,总反应:MH+NiOOH=M+Ni(OH)2 ,以上式中M为储氢合金,MH为吸附了氢原子的储氢合金.
解答 解:A、放电时,正极:NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B、为了防止MH被氢离子氧化,镍氢电池中电解液为碱性溶液,主要为KOH作电解液,故B正确;
C、充电时,负极作阴极,阴极反应为M+H2O+e-=MH+OH-,故C错误;
D、M为储氢合金,MH为吸附了氢原子的储氢合金,储氢材料,其氢密度越大,电池的能量密度越高,故D正确;
故选C.
点评 本题考查了原电池和电解池原理,明确题给信息的含义是解本题关键,难点的电极反应式的书写,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
1.地壳中含量最多的元素所形成的单质( )
| A. | 常温下为固态 | B. | 在空气中含量也最多 | ||
| C. | 可用来灭火 | D. | 能使带火星的木条复燃 |
19.我国酸雨形成的主要原因是( )
| A. | 石油、天然气等燃烧产生大量二氧化碳 | |
| B. | 大量燃烧含硫量高的煤产生二氧化硫 | |
| C. | 森林遭到乱砍烂伐,破坏了生态环境 | |
| D. | 各种机动车排放的尾气 |
16.下列叙述正确的是( )
| A. | 1 mol H2SO4 的质量为98 g•mol-1 | |
| B. | H2SO4的摩尔质量为98 g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8 g |
20.某原电池构造如图所示.下列有关叙述正确的是( )

| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
18.根据实验室制取某干燥气体的装置图(如图所示),判断气体发生装置中的药品可能是( )
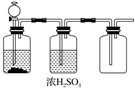

| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |

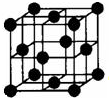 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题: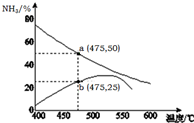 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.