题目内容
3.已知反应mX(g)+nY(g)?qZ(g)+pW(s)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是( )| A. | 通入氦气使密闭容器中压强增大,平衡向正反应方向移动 | |
| B. | 增加X的物质的量,混合气体的密度减小 | |
| C. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| D. | 降低温度,混合气体的平均相对分子质量增大 |
分析 A、化学平衡恒容恒温条件,加入惰气总压增大,分压不变,平衡不动;
B、增加X的物质的量,气体质量质量增大,体积不变,密度增大;
C、速率之比等于计量数之比;平衡时正逆反应速率相同;
D、降温平衡正向进行,气体质量减小,物质的量减小,混合气体的平均相对分子质量变化不定.
解答 解:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、增加X的物质的量,气体质量质量增大,体积不变,密度增大,故B错误;
C、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比,X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍说明反应到达平衡,故C正确;
D、降低温度平衡向正反应移动,反应混合气体总的物质的量减小,混合气体总质量减小,结合M=$\frac{m}{M}$,知混合气体的平均摩尔质量变化未知,故D错误;
故选C.
点评 本题考查化学平衡移动的影响因素、化学平衡状态的判断等,难度中等,A为易错点,注意压强的变化不能引起浓度的变化化学平衡不移动,反应前后气体的体积不变化,即使引起浓度不变,但化学平衡不移动.题目难度中等.

练习册系列答案
相关题目
8. 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
(1)已知:
2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如表:
①该反应的△H<0.(填“>”、“=”或“<”).
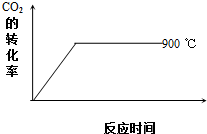
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
(3)以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:(1)已知:
2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如表:
| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
12.下列说法正确的是( )
| A. | 制取水泥和玻璃的原料中均有纯碱 | |
| B. | 普通玻璃是电的绝缘体,这种透明的固体物质是混合物,无固定的熔点 | |
| C. | 普通玻璃俗称水玻璃 | |
| D. | 硅酸盐工业使用的每一种原料都含有硅 |
13.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 氢氧燃料电池在酸性介质中的正极反应式:O2+4H++4e-═2H2O | |
| B. | 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ | |
| D. | 反应HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H<0,在理论上能用于设计原电池 |
 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题: