题目内容
11.已知下列热化学方程式:①CaCO3(s)═CaO(s)+CO2(g)△H=+177.7kJ/mol
②C(s)+H2O(g)═CO(g)+H2(g)△H=-131.3kJ/mol
③$\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-114.6kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤2CO(g)+O2(g)═2CO2(g)△H=-564kJ/mol
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑦CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的是(填序号)②,不正确的理由是该反应为吸热反应,△H应该大于0.
(2)根据上述信息,写出C与O2反应生成CO的热化学方程式C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-111.5KJ/mol.
(3)上述反应中,表示燃烧热的热化学方程式有(填序号,下同)④;表示中和热的热化学方程式有⑥.
分析 (1)热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,根据热化学方程式的书写方法来回答;
(2)结合化学反应④⑤,利用盖斯定律来回答;
(3)燃烧热是指在25℃,101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,中和热是指稀的强酸和强碱反应生成1mol水所放出的热量,据此分析.
解答 解:(1)根据热化学方程式的书写方法,②C(s)+H2O(g)═CO(g)+H2(g)是吸热反应,△H应该大于0,即△H=+131.3KJ/mol;
故答案为:②;该反应为吸热反应,△H应该大于0;
(2)已知④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤2CO(g)+O2(g)═2CO2(g)△H=-564kJ/mol
利用盖斯定律,④-⑤×$\frac{1}{2}$得到反应C(s)+$\frac{1}{2}$O2(g)=CO(g),所以焓变△H=-111.5KJ/mol,则C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-111.5KJ/mol;
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-111.5KJ/mol;
(3)上述反应中,④分别是表示C的燃烧热的热化学方程式,⑥表示的是中和热的热化学方程式,
故答案为:④;⑥.
点评 本题考查学生热化学方程式的书写方法以及盖斯定律计算化学反应的焓变等知识,注意知识的归纳和整理是解题关键,难度不大,侧重于考查学生对基础知识的应用能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下面是溶解性表中的部分内容(室温下测定):
下列有关说法中正确的是( )
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
16.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)?2C(g)△H<0.某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,选项中判断正确的是( )
| A. | 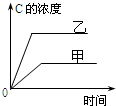 研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 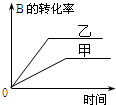 研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 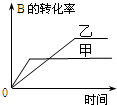 研究的是温度对反应的影响,且乙的温度较高 | |
| D. | 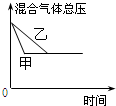 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
3.已知反应mX(g)+nY(g)?qZ(g)+pW(s)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法一定正确的是( )
| A. | 通入氦气使密闭容器中压强增大,平衡向正反应方向移动 | |
| B. | 增加X的物质的量,混合气体的密度减小 | |
| C. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| D. | 降低温度,混合气体的平均相对分子质量增大 |
20.有关溶度积Ksp的说法正确的是( )
| A. | Ksp的数值只与温度有关 | |
| B. | Ksp的数值只与难溶电解质的性质和温度有关 | |
| C. | Ksp的大小与沉淀量有多少和溶液中离子浓度的大小有关 | |
| D. | Ksp的数值越大,电解质在水中的溶解能力越强 |
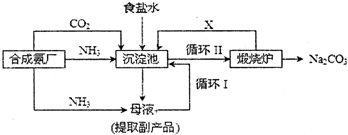
1.工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
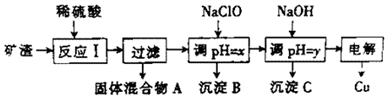
已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
(1)反应I中,与铁元素有关反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+.
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.

已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
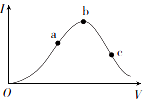 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.