题目内容
A、B、C是三种元素的原子,质子数都小于18.A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3,C原子的质子数比A少4.回答下列问题:
(1)A、B、C的元素符号分别为 、 、 ;
(2)A的离子结构示意图为 ;A与C组成的化合物为 (用具体元素符号表示);
(3)C单质与稀盐酸反应的化学方程式为 ;
(4)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为 .
(1)A、B、C的元素符号分别为
(2)A的离子结构示意图为
(3)C单质与稀盐酸反应的化学方程式为
(4)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C是三种元素的原子,质子数都小于18,A原子与B原子的最外层电子数都是6,A、B都属于第VIA族元素,A原子与C原子的核外电子层数都为3,则A、C都是第三周期元素,则A位于第三周期第VIA族,则A是S元素,B为O元素,C原子的质子数比A少4,则C是Mg元素,
(1)通过以上分析确定这三种元素;
(2)A离子核外有3个电子层、最外层电子数是8,据此确定A离子结构示意图;A、C元素通过得失电子形成离子化合物硫化镁;
(3)C是Mg元素,镁和稀盐酸反应生成氯化镁和氢气;
(4)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1molSO42-的质量为104g,则硫酸根离子的摩尔质量是104g/mol,摩尔质量在数值上等于其相对分子质量,所以该硫酸根离子相对分子质量为104,先计算每个氧原子相对原子质量,一种核素的相对原子质量在数值上等于质子数+中子数,据此计算元素B的该核素中的中子数.
(1)通过以上分析确定这三种元素;
(2)A离子核外有3个电子层、最外层电子数是8,据此确定A离子结构示意图;A、C元素通过得失电子形成离子化合物硫化镁;
(3)C是Mg元素,镁和稀盐酸反应生成氯化镁和氢气;
(4)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1molSO42-的质量为104g,则硫酸根离子的摩尔质量是104g/mol,摩尔质量在数值上等于其相对分子质量,所以该硫酸根离子相对分子质量为104,先计算每个氧原子相对原子质量,一种核素的相对原子质量在数值上等于质子数+中子数,据此计算元素B的该核素中的中子数.
解答:
解:A、B、C是三种元素的原子,质子数都小于18,A原子与B原子的最外层电子数都是6,A、B都属于第VIA族元素,A原子与C原子的核外电子层数都为3,则A、C都是第三周期元素,则A位于第三周期第VIA族,则A是S元素,B为O元素,C原子的质子数比A少4,则C是Mg元素,
(1)通过以上分析知,A、B、C分别是S、O、Mg元素,故答案为:S;O;Mg;
(2)A离子核外有3个电子层、最外层电子数是8,则A离子结构示意图为 ;A、C元素通过得失电子形成离子化合物MgS,故答案为:
;A、C元素通过得失电子形成离子化合物MgS,故答案为: ;MgS;
;MgS;
(3)C是Mg元素,镁和稀盐酸反应生成氯化镁和氢气,反应方程式为Mg+2HCl=MgCl2+H2↑,
故答案为:Mg+2HCl=MgCl2+H2↑;
(4)1molSO42-的质量为104g,则硫酸根离子的摩尔质量是104g/mol,摩尔质量在数值上等于其相对分子质量,所以该硫酸根离子相对分子质量为104,该氧原子相对原子质量=
=18,核素的相对原子质量在数值上等于其质量数,该氧原子质子数是8,则中子数=18-8=10,
故答案为:10.
(1)通过以上分析知,A、B、C分别是S、O、Mg元素,故答案为:S;O;Mg;
(2)A离子核外有3个电子层、最外层电子数是8,则A离子结构示意图为
 ;A、C元素通过得失电子形成离子化合物MgS,故答案为:
;A、C元素通过得失电子形成离子化合物MgS,故答案为: ;MgS;
;MgS;(3)C是Mg元素,镁和稀盐酸反应生成氯化镁和氢气,反应方程式为Mg+2HCl=MgCl2+H2↑,
故答案为:Mg+2HCl=MgCl2+H2↑;
(4)1molSO42-的质量为104g,则硫酸根离子的摩尔质量是104g/mol,摩尔质量在数值上等于其相对分子质量,所以该硫酸根离子相对分子质量为104,该氧原子相对原子质量=
| 104-32 |
| 4 |
故答案为:10.
点评:本题考查位置结构性质的相互关系及应用,熟练原子结构、元素周期表结构、物质结构是解本题关键,知道元素化合物的性质,注意元素元素相对原子质量与该元素的一种原子相对原子质量的关系,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
同物质的量浓度的下列物质中导电能力最强的是( )
| A、氯化钠 | B、硫酸 | C、盐酸 | D、酒精 |
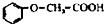 有多种同分异构体,其中属于酯类、能与FeCl3溶液发生显色反应、且苯环上有2种一硝基取代物的同分异构体的结构简式有
有多种同分异构体,其中属于酯类、能与FeCl3溶液发生显色反应、且苯环上有2种一硝基取代物的同分异构体的结构简式有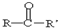 (R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.
(R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.