题目内容
短周期元素A、B、C、D的原子序数依次递增.A、B、C其原子的最外层电子数之和为9.A与B、C、D位于相邻周期,C原子最外层电子数是A原子次外层电子数的2倍或者是B原子最外层电子数的4倍.化合物BD是生活中一种重要的调味品.试回答下列问题:
(1)B在周期表中的位置: .实验室常将少量B的单质保存在 .
(2)A、C的单质与它们生成的化合物的晶体类型相同,在常温时硬度很大,则晶体类型是 ;熔点由高到低的顺序为 (填元素符号或化学式).
(3)工业上用惰性电极电解BD饱和溶液时的阳极反应式为 .工业上生产B的单质的化学方程式为 .
(1)B在周期表中的位置:
(2)A、C的单质与它们生成的化合物的晶体类型相同,在常温时硬度很大,则晶体类型是
(3)工业上用惰性电极电解BD饱和溶液时的阳极反应式为
考点:位置结构性质的相互关系应用
专题:
分析:短周期元素A、B、C、D的原子序数依次递增,最外层电子数不超过8个,如果第一电子层为最外层,则最外层电子数不超过2个,C原子最外层电子数是A原子次外层电子数的2倍或者是B原子最外层电子数的4倍,则A原子次外层有2个电子,化合物BD是生活中一种重要的调味品,则BD为NaCl,所以B是Na元素、D是Cl元素,C原子最外层电子数是B原子最外层电子数的4倍,则C是Si元素;
A、B、C其原子的最外层电子数之和为9,则A是C元素,再结合物质结构、物质性质分析解答.
A、B、C其原子的最外层电子数之和为9,则A是C元素,再结合物质结构、物质性质分析解答.
解答:
解:短周期元素A、B、C、D的原子序数依次递增,最外层电子数不超过8个,如果第一电子层为最外层,则最外层电子数不超过2个,C原子最外层电子数是A原子次外层电子数的2倍或者是B原子最外层电子数的4倍,则A原子次外层有2个电子,化合物BD是生活中一种重要的调味品,则BD为NaCl,所以B是Na元素、D是Cl元素,C原子最外层电子数是B原子最外层电子数的4倍,则C是Si元素;A、B、C其原子的最外层电子数之和为9,则A是C元素,
(1)B是Na元素,其原子核外有3个电子层、最外层电子数是1,所以在周期表中的位置:第三周期第IA族,钠的密度大于煤油且不和煤油反应,钠易和氧气、水反应,所以实验室常将少量B的单质保存在煤油中,故答案为:第三周期第IA族;煤油;
(2)原子晶体的熔沸点较高且硬度较大,Si、C的单质及它们生成的化合物常温下硬度较大,则晶体类型是 原子晶体,原子晶体的熔点与其键长成反比,键长C-C<C-Si<Si-Si,所以熔点由高到低的顺序为 C>SiC>Si,故答案为:原子晶体; C>SiC>Si;
(3)工业上用惰性电极电解BD饱和溶液时,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,Na属于活泼金属,工业上采用电解熔融氯化钠的方法冶炼,反应方程式为2NaCl(熔融)
2Na+Cl2↑,故答案为:2Cl--2e-=Cl2↑;2NaCl(熔融)
2Na+Cl2↑.
(1)B是Na元素,其原子核外有3个电子层、最外层电子数是1,所以在周期表中的位置:第三周期第IA族,钠的密度大于煤油且不和煤油反应,钠易和氧气、水反应,所以实验室常将少量B的单质保存在煤油中,故答案为:第三周期第IA族;煤油;
(2)原子晶体的熔沸点较高且硬度较大,Si、C的单质及它们生成的化合物常温下硬度较大,则晶体类型是 原子晶体,原子晶体的熔点与其键长成反比,键长C-C<C-Si<Si-Si,所以熔点由高到低的顺序为 C>SiC>Si,故答案为:原子晶体; C>SiC>Si;
(3)工业上用惰性电极电解BD饱和溶液时,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,Na属于活泼金属,工业上采用电解熔融氯化钠的方法冶炼,反应方程式为2NaCl(熔融)
| ||
| ||
点评:本题考查位置结构性质的关系及相互应用,侧重考查原子结构、物质结构及物质性质,熟练掌握原子结构,知道金属活泼性强弱与冶炼方法的关系,知道原子晶体熔点高低的影响因素,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
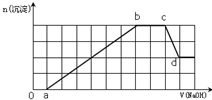 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质有Na2SO4、NaAlO2、NH3?H2O |
| B、原溶液中含有的Fe3+、Mg2+和Al3+的物质的量之比为1:1:1 |
| C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓ |
| D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,将粗盐溶于水,进行下列操作:①过滤;②加入适量的盐酸;③加入过量的氯化钡溶液;④加入过量的氢氧化钠溶液;⑤加入过量的碳酸钠溶液.正确的操作顺序是( )
| A、④③⑤②① |
| B、④③⑤①② |
| C、④⑤③①② |
| D、④⑤③②① |