题目内容
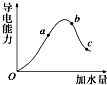 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:(1)O点为什么不导电
(2)a、b、c三点溶液的pH由小到大的顺序是
(3)H+的物质的量最大的是
(4)醋酸的电离程度最大的是
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大;
(4)溶液越稀,越促进醋酸电离;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大;
(4)溶液越稀,越促进醋酸电离;
解答:
解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,故答案为:无自由移动的离子;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故答案为:b<a<c;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,所以氢离子物质的量最大的是c,故选c;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c,故答案为:c.
(2)导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,故答案为:b<a<c;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,所以氢离子物质的量最大的是c,故选c;
(4)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c,故答案为:c.
点评:本题考查电解质的电离,题目难度中等,易错选项是D,加水稀释醋酸,能促进醋酸电离,但溶液中醋酸根离子增大的量远远小于水体积增大的量,所以醋酸根离子浓度减小,为易错点.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
实验室里进行过滤和蒸发操作都要用到的仪器是( )
| A、漏斗 | B、玻璃棒 |
| C、蒸发皿 | D、酒精灯 |
将0.1mol?L-1的醋酸溶液加水稀释,则( )
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素.下列说法正确的( )
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |
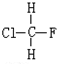 与
与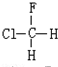
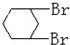 与
与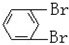
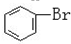 与
与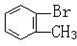
 与
与
 与CH3-CH2Cl.
与CH3-CH2Cl.