题目内容
17.将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后溶液中加入2mol•L-1NaOH溶液60mL时金属离子恰好沉淀完全.则形成沉淀的物质的量为( )| A. | 0.03mol | B. | 0.06mol | C. | 0.12mol | D. | 0.24mol |
分析 铜和镁都是+2价金属,二者与稀硝酸反应都生成NO气体,根据n=$\frac{V}{{V}_{m}}$计算出NO的物质的量,然后设出Cu、Mg的物质的量,利用电子守恒可计算出铜和镁的总物质的量,从而可知生成氢氧化铜、氢氧化镁的物质的量.
解答 解:金属与酸恰好完全反应生成一氧化氮气体,Mg、Cu都是+2价金属,设Mg和Cu物质的量分别为xmol、ymol,
由得失电子相等得:2x+2y=3n(NO)=$\frac{0.896L}{22.4L/mol}$×3=0.12mol,则形成沉淀的物质的量为:x+y=0.06mol,
故选B.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
7.浓硝酸不具有的性质是( )
| A. | 不稳定性 | B. | 可溶解水晶 | C. | 强氧化性 | D. | 易挥发性 |
8.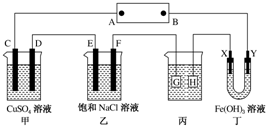 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:1 | |
| C. | 欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | 装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 |
5.以下几个热化学方程式,能表示燃烧热的热化学方程式是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
2.下列反应中,属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中 | ||
| C. | 木炭在高温下与CO2反应生成CO | D. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ |
9.下列实验设计方案错误的是( )
| A. | 除去Cu(NO3)2溶液中混有的AgNO3:加入适量铜粉 | |
| B. | 分离溴和CCl4的混合物:分液 | |
| C. | 区分NaCl和KCl溶液:焰色反应 | |
| D. | 检验某未知溶液中的SO42-:加入稀硝酸酸化的BaCl2溶液 |
19.在含有下列离子组的溶液中,加入Fe(NO3)2固体后,仍然能够大量共存的离子组是( )
| A. | K+、SO42-、NH4+、CO32- | B. | K+、Ba2+、OH-、Cl- | ||
| C. | Na+、H+、Cl-、SO42- | D. | Na+、Mg2+、Cl-、NO3- |