题目内容
下列说法正确的是( )
| A、15 g乙烷所含极性共价键的数目为3×6.02×1023 |
| B、标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
| C、常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
| D、一定条件下,2 mol 二氧化硫和1 mol 氧气混合,反应时转移的电子数为4×6.02×1023 |
考点:阿伏加德罗常数
专题:
分析:A、根据乙烷的结构判断,乙烷的分子式为C2H6,1个乙烷分子中含有1个C-C键,6个H-H键;
B、从臭氧的分子式判断,分子式为O3;
C、醋酸为弱电解质,部分电离;
D、根据二者的反应为可逆反应判断,不能完全反应.
B、从臭氧的分子式判断,分子式为O3;
C、醋酸为弱电解质,部分电离;
D、根据二者的反应为可逆反应判断,不能完全反应.
解答:
解:A、乙烷的分子式为C2H6,1个乙烷分子中含有1个C-C键,6个H-H键,15g乙烷的物质的量为
=0.5mol,则15g乙烷含极性共价键的物质的量为
×6=3mol,故数目为3×6.02×1023,故A正确;
B、臭氧的分子式为O3,11.2L臭氧中含氧原子的物质的量为
=1.5mol,含氧原子数为1.5×6.02×1023,故B错误;
C、醋酸为弱电解质,部分电离,常温下,100mLO.1mol/L醋酸溶液中含醋酸分子小于0.01×6.02×1023,故C错误;
D、二氧化硫和l氧气反应为可逆反应判断,不能完全反应,一定条件下2mol二氧化硫和1mol氧气混合,反应时转移的电子数小于4×6.02×1023,故D错误.
故选A.
| 15g |
| 30g/mol |
| 15g |
| 30g/mol |
B、臭氧的分子式为O3,11.2L臭氧中含氧原子的物质的量为
| 11.2L |
| 22.4L/mol |
C、醋酸为弱电解质,部分电离,常温下,100mLO.1mol/L醋酸溶液中含醋酸分子小于0.01×6.02×1023,故C错误;
D、二氧化硫和l氧气反应为可逆反应判断,不能完全反应,一定条件下2mol二氧化硫和1mol氧气混合,反应时转移的电子数小于4×6.02×1023,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、牛油是纯净物,它不属于高分子 |
| B、牛油是一种高级脂肪酸 |
| C、牛油可以水解 |
| D、牛油比花生油要好,可以代替花生油使用 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示,下列叙述中正确的是( )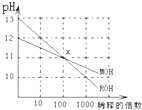

| A、MOH和ROH都是强碱 |
| B、在x点,c(M+)=c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性 |
下列物质中,属于电解质的是( )
| A、蔗糖 | B、盐酸 |
| C、氯化钠 | D、二氧化碳 |
下列离子方程式正确的是( )
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水)
| ||||
| C、氢氧化铜与稀硫酸反应:H++OH-═H2O | ||||
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
下列说法正确的是( )
| A、二氧化碳分子中存在共价键和分子间作用力 |
| B、甲烷、氨和水都是由极性键结合而成的极性分子 |
| C、同主族不同元素的最高价氧化物,一定具有相同的晶体结构 |
| D、氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点 |
下列反应的离子方程式书写正确的是( )
| A、钠和水反应 Na+H2O═Na++OH-+H2↑ |
| B、Cl2与KBr溶液反应 Cl2+2Br-═2Cl-+Br2 |
| C、氯气与NaOH溶液反应 Cl2+OH-═Cl-+ClO-+H2O |
| D、盐酸与石灰石反应 CO32-+2H+═CO2↑+H2O |
