题目内容
3.用如图所示装置进行实验,实验现象与对应的结论正确的是( )| 装置 | ① | ② | 实验现象 | 结论 | |
 | A | 铜丝 | 稀硝酸 | ②中出现红棕色气体 | 稀硝酸与铜生成了NO2 ③中需要碱溶液吸收尾气 |
| B | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液 发生置换反应 | |
| C | 铁丝 | 饱和 食盐水 | ③中导管内液面上升 | 铁钉发生吸氧腐蚀 | |
| D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Cu和稀硝酸反应生成NO、Cu和浓硝酸反应生成NO2;
B.Cu和Fe 3+发生氧化还原反应生成Cu 2+和Fe 2+;
C.中性或弱酸性溶液中Fe发生吸氧腐蚀;
D.常温下铁和浓硫酸发生钝化现象.
解答 解:A.Cu和稀硝酸反应生成NO、Cu和浓硝酸反应生成NO2,所以该实验中生成无色的NO,NO和装置中的氧气反应生成NO2,所以得到的结论错误,故A错误;
B.Cu和Fe 3+发生氧化还原反应生成Cu 2+和Fe 2+,铁离子呈黄色,铜离子为蓝色、亚铁离子为浅绿色,所以反应后溶液黄色变浅,Cu不能转换出Fe,故B错误;
C.中性或弱酸性溶液中Fe发生吸氧腐蚀,氯化钠溶液呈中性,所以发生吸氧腐蚀,导致②压强降低,所以③中导管内液面上升,故C正确;
D.常温下铁和浓硫酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步反应,为钝化现象,所以结论错误,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,明确化学反应原理、元素化合物性质是解本题关键,侧重考查学生分析判断、实验操作能力,注意:钝化不是不发生反应,题目难度不大.

练习册系列答案
相关题目
12.分子式为C5H8O2的有机物,能水解且能发生银镜反应,则符合上述条件同分异构体(不考虑立体异构)有( )
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
18.下列对有机物结构或性质的描述中,错误的是( )
| A. | 乙醇通过消去反应可制得乙烯 | |
| B. | CH3CH=CHCH3分子中的4个碳原子在同一平面上 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 在溴水中加入苯,振荡后溴水的颜色变浅,这是由于发生了加成反应 |
8.25℃时,0.1mol•L-1的3种溶液 ①盐酸 ②氨水 ③CH3COONa溶液.下列说法中,不正确的是( )
| A. | 3种溶液中pH最小的是① | |
| B. | 3种溶液中水的电离程度最大的是② | |
| C. | ①与②等体积混合后溶液显酸性 | |
| D. | ①与③等体积混合后c(H+)>c(CH3COO-)>c(OH-) |
15.乙醇、正戊烷、苯是常见有机物,下列说法正确的是( )
| A. | 苯和溴水共热生成溴苯 | |
| B. | 2,2-二甲基丙烷是正戊烷的同系物 | |
| C. | 乙醇、正戊烷、苯均可通过石油的分馏得到 | |
| D. | 乙醇、正戊烷、苯均能发生取代反应和氧化反应 |
12.氰化钾(KCN)足常用的分析试剂,露置空气中吸收H2O和CO2产生HCN.下列叙述不正确的是( )
| A. | 氰化钾中含有离子键和极性键 | |
| B. | 氰化钾中碳元素的化合价为+4价 | |
| C. | KCN与KMnO4溶液反应可能生成CO2和N2 | |
| D. | 相同条件下,KCN溶液的碱性强于CH3COOK溶液 |
13.将后者逐渐滴入(或通入)前者至过量,有沉淀产生且最终消失的是( )
| A. | 氯化铝、氨水 | B. | 氢硫酸、氧气 | C. | 硫酸铝、氢氧化钠 | D. | 氯化亚铁、氯气 |
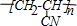 .
.