题目内容
19.砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.(1)砷的氢化物的化学式为AsH3,其稳定性比磷的氢化物弱(填“强或弱”).已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为2H3AsO3+3H2SO4=As2(SO4)3+6H2O.NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-)>C(AsO33-)(填“>”、“<”或“=”).
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原.写出焦炭还原时发生反应的化学方程式:2As2O3+3C$\frac{\underline{\;高温\;}}{\;}$4As+3CO2.砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3.写出上述鉴定过程中有关反应的化学方式:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,2AsH3=2As↓+3H2.
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为2:5.
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的PH为<7.(填“>”、“<”、“=”)判断依据为H2AsO4-+H2O?H3AsO4+OH-,Kh=Kw/K1=1.0×10-14/6×10-3=1.67×10-12<K2,水解程度小于电离程度.
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O?AsO33-+I2+2OH-.
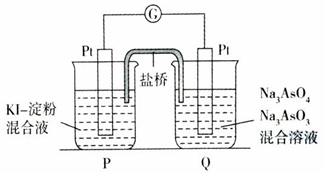
当P池中溶液由无色变成蓝色时,正极上的电极反应式为AsO43-+H2O+2e-=AsO33-+2OH-.
当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为Q(填“P”或“Q”).
分析 (1)砷(As)是第四周期第VA族元素,最低负价为-3价,则砷的氢化物化学式为AsH3;同主族从上到下非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱;H3AsO3是两性偏酸性的化合物,与硫酸反应生成盐和水;Na2HAsO3溶液呈碱性,说明HAsO32-水解程度大于电离程度;
(2)①As2O3与焦炭在高温下反应生成As和CO2,锌、硫酸混合在一起反应生成氢气,氢气与As2O3反应生AsH3,AsH3在热玻璃管中分解成As和H2;
②漂白精的主要成分是NaClO,NaClO将As氧化为H3AsO4,NaClO中氯的化合价降低2价,As的化合价升高5价,则还原剂As与氧化剂NaClO物质的量之比为2:5;
(3)①NaH2AsO4溶液水解呈碱性,电离呈酸性,Kh=Kw/K1=1.0×10-14/6×10-3=1.67×10-12<K2,水解程度小于电离程度,则NaH2AsO4溶液呈酸性;
②正极上得电子发生还原反应,电极反应式为:AsO43-+H2O+2e-=AsO33-+2OH-;当电流计指针归中后向Q池中加入一定量的NaOH,反应逆向进行,AsO33-失电子被氧化成AsO43-,则Q为电池的负极.
解答 解:(1)砷(As)是第四周期第VA族元素,最低负价为-3价,则砷的氢化物化学式为AsH3;磷与砷是同主族,同主族从上到下非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,则砷的氢化物稳定性更弱;H3AsO3是两性偏酸性的化合物,与硫酸反应生成硫酸砷和水,方程式为2H3AsO3+3H2SO4=As2(SO4)3+6H2O;Na2HAsO3溶液呈碱性,说明HAsO3-水解大于电离程度,则c(H2AsO3-)>(AsO33-),
故答案为:AsH3;弱;2H3AsO3+3H2SO4=As2(SO4)3+6H2O;>;
(2)①As2O3与焦炭在高温下反应生成As和CO2,方程式为:2As2O3+3C$\frac{\underline{\;高温\;}}{\;}$4As+3CO2;锌、硫酸混合在一起反应生成氢气,氢气与As2O3反应生AsH3,AsH3在热玻璃管中分解成As和H2,反应方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,2AsH3=2As↓+3H2,
故答案为:2As2O3+3C$\frac{\underline{\;高温\;}}{\;}$4As+3CO2;As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O,2AsH3=2As↓+3H2;
②漂白精的主要成分是NaClO,NaClO将As氧化为H3AsO4,NaClO中氯的化合价降低2价,As的化合价升高5价,则还原剂As与氧化剂NaClO物质的量之比为2:5;
故答案为:2:5;
(3)①NaH2AsO4溶液水解呈碱性,电离呈酸性,Kh=Kw/K1=1.0×10-14/6×10-3=1.67×10-12<K2,水解程度小于电离程度,则NaH2AsO4溶液呈酸性,
故答案为:<;H2AsO4-+H2O?H3AsO4+OH-,Kh=Kw/K1=1.0×10-14/6×10-3=1.67×10-12<K2,水解程度小于电离程度;
②正极上得电子发生还原反应,电极反应式为:AsO43-+H2O+2e-=AsO33-+2OH-;当电流计指针归中后向Q池中加入一定量的NaOH,反应逆向进行,AsO33-失电子被氧化成AsO43-,则Q为电池的负极,
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
点评 本题考查了元素同期表的基础知识以及溶液的酸碱性判断,结合化学平衡考查了原电池电极反应式的书写、电极的判断,根据题意书写化学方程式,学生要在读懂题目条件的情况下解题,考查学生筛选信息的能力,题目难度适中.

 阅读快车系列答案
阅读快车系列答案| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 苯和苯乙烯都不能使酸性高锰酸钾溶液褪色 | |
| C. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
| A. | C2H3Cl | B. | CHCl3 | C. | CH3CH═CH2 | D. | CH3-CH3 |
| A. | 将58.5gNaCl溶于1L水中所得溶液的物质的量浓度为1mol•L-1 | |
| B. | 将5.85molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后浓度为1mol•L-1 | |
| C. | 引流时,玻璃棒可以靠在容量瓶的瓶口上 | |
| D. | 需要480mL0.1mol•L-1的NaCl溶液,配制时应选用500mL容量瓶 |
 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.
 .
.