题目内容
17.高温超导材料是科学家研究的重点物质之一.(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图1所示.该富勒烯化合物中的化学式为K3C60.
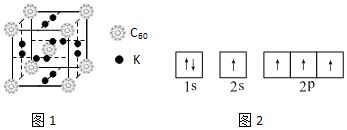
(2)某同学画出的C的基态原子核外电子轨道表示式(如图2),该电子排布图违背了能量最低原理.
(3)金属钾采用的是图3下列A(填字母代号)堆积方式,每个钾原子的配位数是8
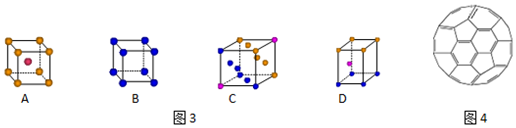
(4)富勒烯(C60)的结构如图4.
①1mol C60分子中σ键的数目为90NA.
②已知:金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm.有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由:错误,因为金刚石是原子晶体,而C60是分子晶体.
分析 (1)利用均摊法确定K原子和C60分子的个数比;
(2)根据能量最低原理可知,电子排布时优先占据能量低的轨道;
(3)钾是体心立方堆积,其配位数是8;
(4)①利用均摊法计算一个碳原子含有的σ键个数,在计算1mol C60分子中σ键的数目;
②物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体.
解答 解:(1)该晶胞中C60个数=1+8×$\frac{1}{8}$=2,6×2×$\frac{1}{2}$=6,所以K原子和C60分子的个数比为6:2=3:1,则化学式为K3C60;故答案为:K3C60;
(2)根据能量最低原理可知,电子排布时优先占据能量低的轨道,先排2s轨道后再排2p轨道,所以其轨道排布图违反了能量最低原理,其电子排布图为: ,
,
故答案为:能量最低原理;
(3)钾是体心立方堆积,其配位数是8,故答案为:A;8;
(4)①1个 C60分子中的一个碳原子含有1.5个σ键,所以一个 C60分子中含有90个σ键,则1mol C60分子中σ键的数目为90NA,
故答案为:90NA;
②原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,物质的熔点与键长无关,所以该说法错误,故答案为:错误,因为金刚石是原子晶体,而C60是分子晶体.
点评 本题考查了物质结构和性质,涉及晶胞的计算、电子排布图等知识点,难度不大,离子配位数的判断是学习难点,会运用均摊法计算化学键、晶胞的化学式等.

练习册系列答案
相关题目
7.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等. 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:
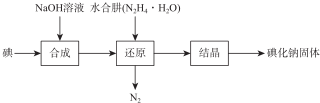
已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为2Fe3++2I-═2Fe2++I2.
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.

已知:N2H4•H2O在100℃以上分解.
(1)已知,在合成过程的反应产物中含有NalO3,则在合成过程中消耗了3mol I2,所生成 NalO3的物质的量为1mol.
(2)写出还原过程中的离子方程式2IO3-+3N2H4•H2O═3N2+2I-+9H2O;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过100℃;请选择下列试剂检测所得碘化钠固体中是否含有NalO3杂质BD(选填字母).
A.FeCl2溶液 B.冰醋酸
C.CKI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol•L-1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3+I2═Na2S4O2+2NaI),重复测定2次,所得的相关数据如下表:
| 测定 序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②加入A物质为淀粉试液(填名称);滴定终点观察到的现象为溶液由浅蓝色褪色,且半分钟内不变色.
③计算该样品中NaI的含量为90%.
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是密封保存.
5.实验室需配制480mL 0.1mol•L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
12.将铝条投到某溶液中产生氢气,则此溶液中一定能够大量共存的离子组是( )
| A. | Ba2+、Cl-、NO3-、K+ | B. | HCO3-、K+、SO42-、Cl- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | Na+、Cl-、K+、SO42-、 |
2.在下列反应中,既属于离子反应又属于氧化还原反应的是( )
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
15. 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是催化剂、吸水剂;
(2)球形干燥管C的作用是防止倒吸反应结束后D中的现象是溶液分层,上层为无色油状液体
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇,然后在混合液中加入沸石(或碎瓷片)再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;
(2)球形干燥管C的作用是防止倒吸反应结束后D中的现象是溶液分层,上层为无色油状液体
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇,然后在混合液中加入沸石(或碎瓷片)再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯.