题目内容
17.表示下列变化的化学用语不正确的是( )| A. | 氨水显碱性:NH3•H2O?NH4++OH- | |
| B. | Na2S溶液显碱性:S2-+2H2O?H2S+2OH- | |
| C. | 硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42- | |
| D. | FeCl3溶液显酸性:Fe3++3H2O?Fe(OH)3+3H+ |
分析 A.NH3•H2O电离出OH-而导致溶液呈碱性;
B.Na2S是二元弱酸强碱正盐,硫离子分两步水解,第一步水解生成硫氢根离子和OH-而导致溶液呈碱性;
C.NaHSO4是强电解质,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子;
D.氯化铁是强酸弱碱盐,铁离子水解导致溶液呈酸性.
解答 解:A.NH3•H2O电离出OH-而导致溶液中c(OH-)>c(H+),所以溶液呈碱性,一水合氨是弱电解质,在水溶液中部分电离,其电离方程式为NH3•H2O?NH4++OH-,故A正确;
B.Na2S是二元弱酸强碱正盐,硫离子分两步水解,第一步水解生成硫氢根离子和OH-而导致溶液呈碱性,其水解方程式为S2-+H2O?HS-+OH-,故B错误;
C.NaHSO4是强电解质,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4═Na++H++SO42-,故C正确;
D.氯化铁是强酸弱碱盐,铁离子水解导致溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,故D正确;
故选B.
点评 本题考查离子方程式的书写,为高频考点,明确电解质强弱、盐类水解特点是解本题关键,注意:多元弱酸根离子分步水解,注意C中硫酸氢钠在水溶液中和熔融状态下电离方程式区别,熔融状态下电离方程式为,NaHSO4═Na++HSO4-,题目难度不大.

练习册系列答案
相关题目
7.下列物质不能通过单质直接化合制备的是( )
| A. | Na2O | B. | FeCl2 | C. | Na2O2 | D. | CuCl2 |
8.“绿色化学”中,最理想的“原子经济”是原子利用率为100%.下列反应类型能体现“原子经济”原则的事①取代反应②酯化反应③加成反应④置换反应⑤水解反应⑥化合反应( )
| A. | ①④ | B. | ②⑤ | C. | ③⑥ | D. | ④⑤ |
5.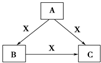 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为Cl2,则C可为FeCl3 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为碳 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
12.下列实验或做法对应的离子方程式正确的是( )
| A. | 将过量SO2气体通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向氢氧化钡溶液中加入少量碳酸氢钠溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| B. | 室温下,1LpH=13的Ba(OH)2溶液中含有的Ba2+个数为0.1NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 78g苯含有C=C键的数目为3NA |
9.下列属于碱性氧化物且易与水发生反应的是( )
| A. | CaO | B. | Al2O3 | C. | CuO | D. | SO2 |
6.2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖.根据物质的分类,青蒿素属于( )
| A. | 碱性氧化物 | B. | 有机物 | C. | 含氧酸盐 | D. | 酸性氧化物 |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含有2NA个氧原子的氧气与臭氧的混合气体的质量为16g | |
| B. | 标准状况下,22.4 mL水中含有的分子数目约为1.24NA | |
| C. | 300 mL 2 mol•L-1酒精溶液中所含分子数为0.6 NA | |
| D. | 1 mol Cl2参加的任何反应转移电子数都是2NA |